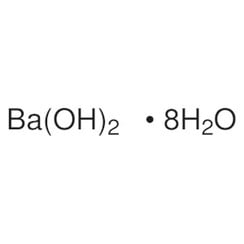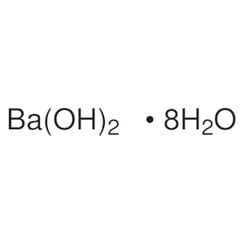No tiene ningún artículo en su cesta
Hidróxido de bario
El hidróxido de bario es un compuesto químico con la fórmula química Ba (OH) 2 (H2O) x. El monohidrato (x = 1), conocido como barita o agua de barita, es uno de los compuestos más importantes del bario. Este monohidrato granulado blanco es la forma comercial habitual.
Aplicaciones
Industrialmente, el hidróxido de bario se utiliza como precursor de otros compuestos de bario. El monohidrato se utiliza para deshidratar y eliminar el sulfato de varios productos. Esta aplicación aprovecha la muy baja solubilidad del sulfato de bario. Esta aplicación industrial también se aplica a aplicaciones de laboratorio.
-Uso de laboratorio
El hidróxido de bario se utiliza en química analítica para la valoración de ácidos débiles, especialmente ácidos orgánicos. Se garantiza que la solución acuosa clara está libre de carbonato, a diferencia de la del hidróxido de sodio y del hidróxido de potasio, ya que el carbonato de bario es insoluble en agua. Esto permite utilizar indicadores como fenolftaleína o timolftaleína (con cambios de color alcalinos) sin riesgo de errores de titulación debido a la presencia de iones carbonato, que son mucho menos básicos.
El hidróxido de bario se utiliza ocasionalmente en síntesis orgánica como base fuerte, por ejemplo para la hidrólisis de ésteres y nitrilos y como base en condensaciones aldólicas.
Se ha utilizado para hidrolizar uno de los dos grupos éster equivalentes en dimetil endecanodioato.
El hidróxido de bario también se utiliza en la descarboxilación de aminoácidos que liberan carbonato de bario.
También se utiliza en la preparación de ciclopentanona, alcohol de diacetona y D-Gulonic γ-lactona.
El hidróxido de bario se descompone en óxido de bario cuando se calienta a 800ºC. La reacción con dióxido de carbono da carbonato de bario. La solución acuosa, fuertemente alcalina, sufre reacciones de neutralización con ácidos. Por tanto, forma sulfato de bario y fosfato de bario con ácido sulfúrico y ácido fosfórico, respectivamente. La reacción con sulfuro de hidrógeno produce sulfuro de bario. La precipitación de muchas sales de bario insolubles o menos solubles puede resultar de una reacción de doble reemplazo cuando una solución acuosa de hidróxido de bario se mezcla con muchas soluciones de otras sales metálicas.
Las reacciones del hidróxido de bario con las sales de amonio son altamente endotérmicas. La reacción de hidróxido de bario octahidrato con cloruro de amonio o tiocianato de amonio se usa a menudo como demostración en el aula, produciendo temperaturas lo suficientemente frías para congelar el agua y suficiente agua para disolver la mezcla resultante.