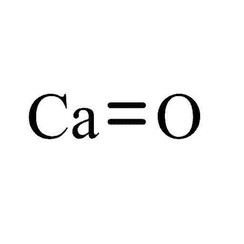No tiene ningún artículo en su cesta
Óxido de calcio
El óxido de calcio (CaO), comúnmente conocido como cal viva o cal quemada, es un compuesto químico ampliamente utilizado. Es un sólido blanco, cáustico, alcalino, cristalino a temperatura ambiente. El término "cal" ampliamente utilizado se refiere a materiales inorgánicos que contienen calcio en los que predominan los carbonatos, óxidos e hidróxidos de calcio, silicio, magnesio, aluminio y hierro. Por el contrario, la cal viva se aplica específicamente al compuesto químico único óxido de calcio. El óxido de calcio que sobrevive al procesamiento sin reaccionar en productos de construcción como el cemento se llama cal libre.
La lima viva es relativamente barata. Tanto él como un derivado químico (hidróxido de calcio, del cual la cal viva es el anhídrido básico) son importantes materias primas químicas.
Aplicaciones
El uso principal de la cal viva se encuentra en el proceso básico de producción de acero al oxígeno (BOS). El uso varía entre 30 y 50 kg (65-110 lb) por tonelada de acero. La cal viva neutraliza los óxidos ácidos, SiO2, Al2O3 y Fe2O3, para producir una escoria básica fundida.
La cal viva molida se utiliza en la producción de bloques de hormigón celular, con una densidad de aproximadamente 0,6 - 1,0 g / cm3 (9,8 - 16,4 g / pulgada cúbica).
La cal viva y la cal hidratada pueden aumentar significativamente la capacidad de carga de los suelos arcillosos. Lo hacen reaccionando con sílice y alúmina finamente divididas para producir silicatos y aluminatos de calcio, que tienen propiedades cementantes.
En otros procesos se utilizan pequeñas cantidades de cal viva; por ejemplo, la producción de vidrio, cemento de aluminato de calcio y productos químicos orgánicos.
Calor: La cal viva libera energía térmica a través de la formación del hidrato, hidróxido de calcio, mediante la siguiente ecuación: al hidratarse, se produce una reacción exotérmica y el sólido estalla. El hidrato se puede convertir en cal viva quitando el agua haciéndola roja para revertir la reacción de hidratación. Un litro de agua se combina con aproximadamente 3,1 kg (6,8 lb) de cal viva para proporcionar hidróxido de calcio más 3,54 MJ de energía. Este proceso se puede utilizar para proporcionar una fuente de calor portátil conveniente, como para el recalentamiento de alimentos en el lugar en una lata de calentamiento automático, para cocinar y calentar agua sin una llama abierta. Varias empresas venden kits de cocina con este método de calentamiento.
Es conocido como aditivo alimentario por la FAO como regulador de la acidez, mejorador de la harina y como masa madre. Tiene el número E E529.
Luz: cuando la cal viva se calienta a 2.400 ° C (4.350 ° F), emite un brillo intenso. Esta forma de iluminación se conoce como reflector y fue ampliamente utilizada en producciones teatrales antes de la invención de la iluminación eléctrica.
Cemento: el óxido de calcio es un ingrediente importante para la fabricación de cemento.
Como álcali barato y ampliamente disponible. Aproximadamente el 50% de la producción total de cal viva se convierte en hidróxido de calcio antes de su uso. Tanto rápido como
La cal hidratada se utiliza en el tratamiento del agua potable.
Industria del petróleo: las pastas de detección de agua contienen una mezcla de óxido de calcio y fenolftaleína. Cuando esta pasta entra en contacto con el agua en un tanque de almacenamiento de combustible, el CaO reacciona con el agua para formar hidróxido de calcio. El hidróxido de calcio tiene un pH lo suficientemente alto como para convertir la fenolftaleína en un vibrante color rosa púrpura, lo que indica la presencia de agua.
Papel: El óxido de calcio se utiliza para regenerar hidróxido de sodio a partir de carbonato de sodio en la recuperación química en las plantas de celulosa Kraft.
Yeso: Existe evidencia arqueológica de que antes de la cerámica, la gente del Neolítico B usaba yeso sobre piedra caliza para pisos y otros usos. Este suelo de ceniza de cal se mantuvo en uso hasta finales del siglo XIX.
Producción química o energética: se pueden usar aerosoles sólidos o lodos de óxido de calcio para eliminar el dióxido de azufre de las corrientes de escape en un proceso llamado desulfuración de gases de combustión.
Minería: los cartuchos de cal comprimida utilizan las propiedades exotérmicas de la cal viva para romper rocas. Se perfora un pozo de explosión en la roca de la manera habitual y se coloca un cartucho sellado de cal viva y se presiona en él. Luego se inyecta una cantidad de agua en el cartucho y la liberación de vapor resultante, junto con el mayor volumen del sólido hidratado restante, rompe la roca. El método no funcionará si la piedra es particularmente dura.
Eliminación de cadáveres: Históricamente, se creía que la cal viva era eficaz para acelerar la descomposición de los cadáveres. Esto fue un error y el uso de cal viva puede incluso promover la conservación; aunque puede ayudar a erradicar el hedor de la descomposición, lo que puede llevar a las personas a asumir que fue la carne real la que se consumió.