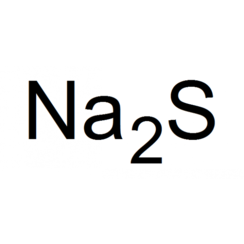No tiene ningún artículo en su cesta
Sulfuro de sodio
El sulfuro de sodio es el compuesto químico con la fórmula Na2S, o más precisamente el hidrato Na2S9H2O. Tanto las sales anhidras como las hidratadas son sólidos incoloros. Son solubles en agua y dan soluciones muy alcalinas. El Na2S y sus hidratos emiten sulfuro de hidrógeno cuando se exponen al aire húmedo, que huele a huevos podridos. Algunas muestras comerciales se especifican como Na2SxH2O, donde se especifica un porcentaje en peso de Na2S. Los grados comúnmente disponibles tienen aproximadamente un 60% en peso de Na2S, lo que significa que x es aproximadamente 3. Tales tipos técnicos de sulfuro de sodio tienen un aspecto amarillo debido a la presencia de polisulfuros. Estos tipos de sulfuro de sodio se comercializan como "escamas de sulfuro de sodio".
Aplicaciones
El sulfuro de sodio se utiliza principalmente en el proceso kraft en la industria de la pulpa y el papel.
Se utiliza en el tratamiento del agua como captador de oxígeno y también como precipitante de metales; en fotografía química para mejorar fotografías en blanco y negro; en la industria textil como blanqueador, desulfuración y declorante; y en el comercio de cueros para la sulfitización de extractos tánicos. Se utiliza en la fabricación de productos químicos como agente sulfonante y sulfometilante. Se utiliza en la producción de productos químicos para caucho, tintes de azufre y otros compuestos químicos. Se utiliza en otras aplicaciones que incluyen flotación de minerales, extracción de aceite, fabricación de colorantes y detergentes. También se utiliza durante el procesamiento del cuero, como agente depilatorio en el tratamiento con cal.
Reactivo en química orgánica
La alquilación de sulfuro de sodio da tioéteres:
Na2S + 2 RX → R2S + 2 NaX
Incluso los haluros de arilo participan en esta reacción. A través de un proceso muy similar, el sulfuro de sodio puede reaccionar con olefinas en la reacción de tiol-eno para dar tioéteres. El sulfuro de sodio se puede utilizar como nucleófilo en reacciones de tipo Sandmeyer. El sulfuro de sodio reduce los derivados de 1,3-dinitrobenceno a 3-nitroanilinas. La solución acuosa de sulfuro de sodio se puede calentar a reflujo con tintes azo que contienen nitro disueltos en dioxano y etanol para reducir selectivamente los grupos nitro a amina; mientras que otros grupos reducibles, p. ej. grupo azo, permanecen intactos. El sulfuro también se ha utilizado en aplicaciones fotocatalíticas.