No tiene ningún artículo en su cesta
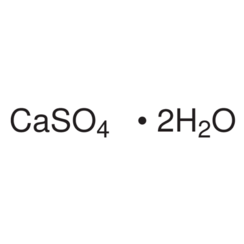
Sulfato de calcio
El sulfato de calcio es el compuesto inorgánico con la fórmula CaSO4 e hidratos relacionados. En forma de γ-anhidrita (la forma anhidra) se utiliza como agente de secado. Un hidrato se conoce más comúnmente como yeso y otro se produce naturalmente como yeso mineral. Tiene muchos usos en la industria. Todas las formas son sólidos blancos que son escasamente solubles en agua. El sulfato de calcio provoca una dureza permanente en el agua.
Aplicaciones
El uso principal del sulfato de calcio es la producción de yeso y estuco. Estos usos aprovechan el hecho de que el sulfato de calcio en polvo y calcinado forma una pasta moldeable al hidratarse y se endurece como sulfato de calcio cristalino dihidratado. También es conveniente que el sulfato de calcio sea escasamente soluble en agua y no se disuelva fácilmente en contacto con el agua después de la solidificación.
-Reacciones de hidratación y deshidratación
Con un calentamiento suave, el yeso se convierte en el mineral parcialmente deshidratado llamado yeso o yeso de París. Este material tiene la fórmula CaSO4 (nH2O), donde 0.5 ≤ n ≤ 0.8. Se requieren temperaturas entre 100 y 150 ° C (212–302 ° F) para expulsar el agua dentro de su estructura. Los detalles de la temperatura y el tiempo dependen de la humedad. En la calcinación industrial se utilizan temperaturas de hasta 170 ° C (338 ° F), pero a estas temperaturas comienza a formarse γ-anhidrita. La energía térmica entregada al yeso en este punto (el calor de la hidratación) tiende a expulsar el agua (como vapor de agua) en lugar de aumentar la temperatura del mineral, que aumenta lentamente hasta que el agua desaparece. y luego aumenta más rápido. La ecuación para la deshidratación parcial es:
CaSO4 2 H2O → CaSO4 1/2 H2O + 1 + 1/2 H2O ↑
La propiedad endotérmica de esta reacción es relevante para el desempeño de los paneles de yeso, impartiendo resistencia al fuego a las estructuras residenciales y de otro tipo. En un incendio, la estructura detrás de una placa de yeso permanece relativamente fría porque se pierde agua del yeso, lo que evita (o ralentiza significativamente) el daño a la moldura (por la quema de piezas de madera o la pérdida de resistencia del acero a altas temperaturas). y consecuentemente colapso estructural. Pero a temperaturas más altas, el sulfato de calcio liberará oxígeno y actuará como un agente oxidante. Esta propiedad se utiliza en energía térmica del aluminio. A diferencia de la mayoría de los minerales, que forman fácilmente pastas líquidas o semilíquidas o permanecen en polvo cuando se rehidratan, el yeso calcinado tiene una propiedad inusual: cuando se mezcla con agua a temperaturas normales (ambiente), rápidamente regresa químicamente a la forma dihidrato deseada , mientras se "ajusta" físicamente para formar una red de cristal de yeso rígida y relativamente fuerte:
CaSO4 1/2 H2O + 1 + 1/2 H2O → CaSO4 2 H2O
Esta reacción es exotérmica y es responsable de la facilidad con la que el yeso se puede verter en una variedad de formas, incluidas láminas (para paneles de yeso), palos (para tiza de pizarra) y moldes (para inmovilizar huesos rotos o para fundición de metales). Mezclado con polímeros, se ha utilizado como cemento reparador de huesos. Se agregan pequeñas cantidades de yeso calcinado al suelo para crear estructuras fuertes directamente del suelo vertido, una alternativa al adobe (que pierde su resistencia cuando está húmedo). Las condiciones de deshidratación se pueden cambiar para ajustar la porosidad del hemihidrato, dando como resultado los llamados hemihidratos α y β (que son más o menos químicamente idénticos).
Cuando se calienta a 180 ° C (356 ° F), se produce la forma casi anhidra llamada γ-anhidrita (CaSO4 nH2O donde n = 0 a 0,05). La γ-anhidrita reacciona lentamente con el agua para volver al estado dihidrato, una propiedad explotada en algunos desecantes comerciales. Cuando se calienta por encima de 250 ° C, se forma la forma completamente anhidra que se llama β-anhidrita o anhidrita "natural". La anhidrita natural no reacciona con el agua, incluso en escalas de tiempo geológicas, a menos que se muele muy finamente.
La composición variable del hemihidrato y la γ-anhidrita, y su fácil interconversión, se debe a sus estructuras cristalinas casi idénticas que contienen "canales" que pueden absorber cantidades variables de agua u otras moléculas pequeñas como el metanol.
-Industria de alimentos
Los hidratos de sulfato de calcio se utilizan como coagulantes en productos como el tofu.
La FDA lo permite en queso y productos derivados del queso; Harina de cereales; Productos de panadería; Postres helados; Edulcorantes artificiales para jaleas y conservas; Verduras de condimento; y condimentar tomates y dulces.
Se conoce en la serie de números E como E516 y la FAO lo conoce como agente reafirmante, agente de tratamiento de la harina, agente secuestrante y agente de elevación.
-Otros usos
Cuando se vende en estado anhidro como desecante con un indicador de color llamado Drierita, aparece azul (anhidro) o rosa (hidratado) por impregnación con cloruro de cobalto (II), que actúa como indicador de humedad.
Se produjeron cantidades comerciales de ácido sulfúrico a partir de sulfato de calcio anhidro en Whitehaven (Cumbria, Reino Unido) hasta la década de 1970. Cuando se mezcla con esquisto o marga y se tuesta, el sulfato libera trióxido de azufre, un precursor en la producción de ácido sulfúrico, la reacción también produce silicato de calcio, una fase mineral esencial en la producción de clínker de cemento.