Non ci sono articoli nel tuo carrello
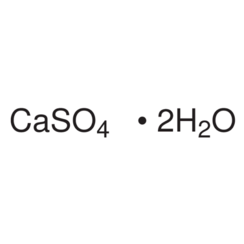
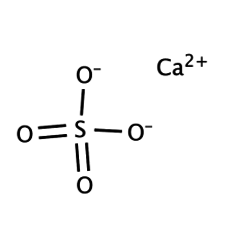
Solfato di calcio
Il solfato di calcio è il composto inorganico di formula CaSO4 e relativi idrati. Sotto forma di γ-anidrite (la forma anidra) viene utilizzata come agente essiccante. Un particolare idrato è più comunemente noto come gesso e un altro si trova naturalmente come gesso minerale. Ha molte applicazioni nell'industria. Tutte le forme sono solidi bianchi poco solubili in acqua. Il solfato di calcio provoca una durezza permanente dell'acqua.
Applicazioni
L'uso principale del solfato di calcio è la produzione di intonaci e stucchi. Queste applicazioni sfruttano il fatto che il solfato di calcio in polvere e calcinato forma una pasta modellabile dopo l'idratazione e si indurisce come solfato di calcio cristallino diidrato. È anche conveniente che il solfato di calcio sia scarsamente solubile in acqua e non si dissolva facilmente a contatto con l'acqua dopo la solidificazione.
-Risposte di idratazione e disidratazione
Con un attento riscaldamento, il gesso viene convertito nel minerale parzialmente disidratato chiamato gesso o gesso di Parigi. Questo materiale ha la formula CaSO4 (nH2O), dove 0,5 n 0,8. Temperature comprese tra 100 e 150 ° C (212-302 ° F) sono necessarie per espellere l'acqua all'interno della sua struttura. I dettagli della temperatura e del tempo dipendono dall'umidità. Temperature fino a 170 ° C (338 ° F) sono utilizzate nella calcinazione industriale, ma a queste temperature inizia a formarsi anidrite. L'energia termica fornita al gesso in questo momento (il calore di idratazione) tende ad allontanare l'acqua (come vapore acqueo) piuttosto che aumentare la temperatura del minerale, che sale lentamente fino a quando l'acqua non si esaurisce e poi aumenta più velocemente. L'equazione per la disidratazione parziale è:
CaSO4 2 H2O → CaSO4 1/2 H2O + 1 + 1/2 H2O
La proprietà endotermica di questa reazione è rilevante per le prestazioni del muro a secco, che conferisce resistenza al fuoco alle strutture residenziali e di altro tipo. In caso di incendio, la struttura dietro un muro a secco rimane relativamente fresca perché l'acqua viene persa dall'intonaco, prevenendo (o ritardando significativamente) i danni alla modanatura (dalla combustione di parti in legno o perdita di resistenza dell'acciaio alle alte temperature). e conseguente crollo strutturale. Ma a temperature più elevate, il solfato di calcio rilascerà ossigeno e agirà come agente ossidante. Questa proprietà è utilizzata in alluminio termico. A differenza della maggior parte dei minerali, che formano facilmente paste liquide o semiliquide o rimangono polverose quando reidratati, il gesso calcinato ha una proprietà insolita: quando miscelato con acqua a temperature normali (ambiente), ritorna rapidamente chimicamente alla forma diidrata desiderata, mentre fisicamente " impostazione" per formare un reticolo cristallino di gesso rigido e relativamente forte:
CaSO4 1/2 H2O + 1 + 1/2 H2O → CaSO4 2 H2O
Questa reazione è esotermica ed è responsabile della facilità con cui il gesso può essere colato in una varietà di forme, inclusi fogli (per cartongesso), bastoncini (per gesso da lavagna) e stampi (per immobilizzare ossa rotte o per fondere metalli). Mescolato con polimeri, è stato utilizzato come cemento per la riparazione ossea. Piccole quantità di gesso calcinato vengono aggiunte alla terra per creare strutture forti direttamente dalla terra colata, un'alternativa all'adobe (che perde la sua forza quando è bagnato). Le condizioni di disidratazione possono essere alterate per regolare la porosità dell'emiidrato, dando luogo ai cosiddetti α- e -emiidrati (che sono più o meno chimicamente identici).
Quando riscaldato a 180 ° C (356 ° F), viene prodotta la forma quasi anidra chiamata γ-anidrite (CaSO4 nH2O dove n = da 0 a 0,05). La γ-Anidrite reagisce lentamente con l'acqua per tornare allo stato diidrato, una proprietà sfruttata in alcuni disseccanti commerciali. Quando riscaldato sopra i 250°C, si forma la forma completamente anidra chiamata β-anidrite o anidrite "naturale". L'anidrite naturale non reagisce con l'acqua, anche su scale temporali geologiche, a meno che non sia macinata molto finemente.
La composizione variabile dell'emiidrato e della -anidrite, e la loro facile interconversione, è dovuta alle loro strutture cristalline quasi identiche che contengono "canali" che possono accettare quantità variabili di acqua o altre piccole molecole come il metanolo.
-Industria alimentare
Gli idrati di solfato di calcio sono usati come coagulante in prodotti come il tofu.
Per la FDA è consentito nel formaggio e nei relativi prodotti caseari; farina di cereali; prodotti da forno; dessert surgelati; dolcificanti artificiali per gelatine e conserve; condimento Verdure; e condimento pomodori e qualche caramella. È noto nella serie E come E516 e la FAO lo conosce come agente rassodante, agente di trattamento della farina, agente sequestrante e agente lievitante.
-Altri usi
Quando posto in stato anidro