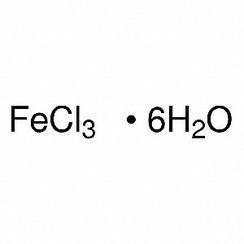No tiene ningún artículo en su cesta
Cloruro férrico
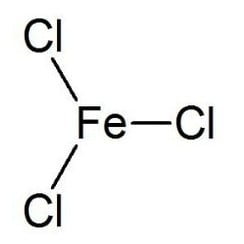
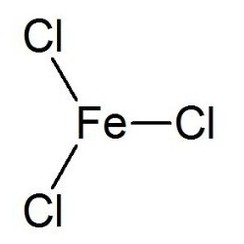
El cloruro de hierro (III) es el compuesto inorgánico de fórmula (FeCl3). También llamado cloruro férrico, es un compuesto común de hierro en el estado de oxidación +3. El compuesto anhidro es un sólido cristalino con un punto de fusión de 307,6 ° C. El color depende del ángulo de visión: los cristales aparecen de color verde oscuro por la luz reflejada, pero aparecen de color rojo púrpura por la luz transmitida.
Estructura y propiedades
-Anhidro
El cloruro de hierro (III) anhidro tiene la estructura BiI3, con centros octaédricos de Fe (III) interconectados por ligandos de cloro de dos coordenadas.
El cloruro de hierro (III) tiene un punto de fusión relativamente bajo y hierve alrededor de 315 ° C.El vapor consiste en el dímero Fe2Cl6 (cloruro de aluminio) que se disocia cada vez más en el FeCl3 monomérico (con simetría molecular del grupo de puntos D3h) a mayor temperatura, en competencia con la descomposición reversible para dar cloruro de hierro (II) y cloro gaseoso.
-Hidratos
Además del material anhidro, el cloruro férrico forma cuatro hidratos. Todas las formas de cloruro de hierro (III) contienen dos o más cloruros como ligandos y tres hidratos contienen FeCl4 -.
hexahidrato: FeCl3.6H2O tiene la fórmula estructural trans- [Fe (H2O) 4Cl2] Cl.2H2O
FeCl3.2.5H2O tiene la fórmula estructural cis- [Fe (H2O) 4Cl2] [FeCl4] .H2O.
dihidrato: FeCl3.2H2O tiene la fórmula estructural trans- [Fe (H2O) 4Cl2] [FeCl4].
FeCl3.3.5H2O tiene la fórmula estructural cis- [FeCl2 (H2O) 4] [FeCl4] .3H2O.
-Solución de agua
Las soluciones acuosas de cloruro férrico son característicamente amarillas, en contraste con las soluciones rosa pálido de [Fe (H2O) 6] 3+. Según mediciones espectroscópicas, las especies más importantes en soluciones acuosas de cloruro férrico son el complejo octaédrico [FeCl2 (H2O) 4] + (estereoquímica no especificada) y el tetraedro [FeCl4] -.
Aplicaciones
-Industrial
El cloruro de hierro (III) se utiliza en el tratamiento de aguas residuales y en la producción de agua potable como coagulante y floculante. En esta aplicación, en agua ligeramente básica, el cloruro férrico reacciona con el ión hidróxido para formar una escama de hidróxido de hierro (III), o más precisamente formulado como FeO (OH) -, que puede eliminar los materiales en suspensión.
También se utiliza como agente de lixiviación en hidrometalurgia de cloruros, por ejemplo en la producción de Si a partir de FeSi (proceso Silgrain).
Otra aplicación importante del cloruro de hierro (III) es el grabado de cobre en una reacción redox de dos pasos al cloruro de cobre (I) y luego al cloruro de cobre (II) en la producción de placas de circuito impreso.
El cloruro de hierro (III) se utiliza como catalizador para la reacción de etileno con cloro para formar dicloruro de etileno (1,2-dicloroetano), una sustancia química importante que se utiliza principalmente en la producción industrial de cloruro de vinilo, el monómero para fabricar PVC.
-Uso de laboratorio
En el laboratorio, el cloruro de hierro (III) se utiliza a menudo como ácido de Lewis para catalizar reacciones como la cloración de compuestos aromáticos y la reacción de Friedel-Crafts de aromáticos. Es menos potente que el cloruro de aluminio, pero en algunos casos esta suavidad conduce a mayores rendimientos, por ejemplo en la alquilación de benceno.
La prueba de cloruro férrico es una prueba colorimétrica tradicional para fenoles, que utiliza una solución de cloruro de hierro (III) al 1% neutralizada con hidróxido de sodio hasta que se forma una ligera precipitación de FeO (OH). La mezcla se filtra antes de su uso. La materia orgánica se disuelve en agua, metanol o etanol y luego se agrega la solución de cloruro de hierro (III) neutralizado; una decoloración transitoria o permanente (generalmente púrpura, verde o azul) indica la presencia de un fenol o enol.
Esta reacción se aprovecha en la prueba de manchas de Trinder, que se utiliza para indicar la presencia de salicilatos, especialmente ácido salicílico, que contiene un grupo OH fenólico.
Esta prueba se puede utilizar para detectar la presencia de ácido gamma-hidroxibutírico y gamma-butirolactona, lo que hace que se torne de color marrón rojizo.
Otros usos
-Utilizado anhidro como reactivo secante en determinadas reacciones.
-Utilizado para detectar la presencia de compuestos fenólicos en síntesis orgánica; examinando, por ejemplo, la pureza de la aspirina sintetizada.
-Utilizado en el tratamiento de aguas y aguas residuales para precipitar fosfato como fosfato de hierro (III).
-Utilizado en el tratamiento de aguas residuales para el control de olores.
-Utilizado por los coleccionistas de monedas de EE. UU. Para identificar las fechas de los postes Buffalo que están tan gastados que la fecha ya no es visible.
Utilizado por los forjadores de cuchillas y los artesanos de soldadura de patrones para grabar el metal, dándole un efecto de contraste, para ver las capas o imperfecciones del metal.
-Utilizado para grabar el patrón widmanstatten en meteoritos de hierro.
-Necesario para grabar planchas de huecograbado para impresión fotográfica y visual