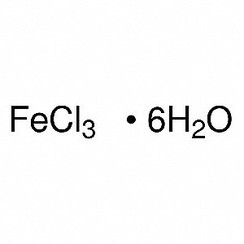Non ci sono articoli nel tuo carrello
Cloruro ferrico
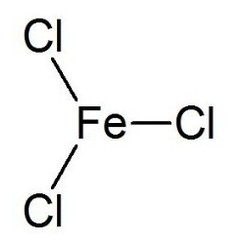
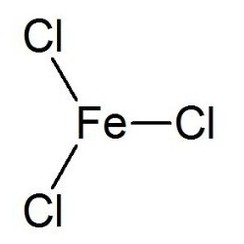
Il cloruro di ferro (III) è il composto inorganico con la formula (FeCl3). Chiamato anche cloruro ferrico, è un comune composto del ferro allo stato di ossidazione +3. Il composto anidro è un solido cristallino con un punto di fusione di 307,6 ° C. Il colore dipende dall'angolo di visione: la luce riflessa fa apparire i cristalli verde scuro, ma la luce trasmessa li fa apparire rosso violaceo.
Struttura e proprietà
-Anidro
Il cloruro di ferro (III) anidro ha la struttura BiI3, con centri Fe (III) ottaedrici interconnessi da leganti di cloro con due coordinate.
Il cloruro di ferro (III) ha un punto di fusione relativamente basso e bolle intorno a 315 ° C.Il vapore è costituito dal dimero Fe2Cl6 (cloruro di alluminio) che si dissocia sempre più nel monomerico FeCl3 (con simmetria molecolare del gruppo puntuale D3h) a temperatura più elevata, in concorrenza con la decomposizione reversibile per dare cloruro di ferro (II) e gas di cloro.
-Idrati
Oltre al materiale anidro, il cloruro ferrico forma quattro idrati. Tutte le forme di cloruro di ferro (III) contengono due o più cloruri come ligandi e tre idrati contengono FeCl4 -.
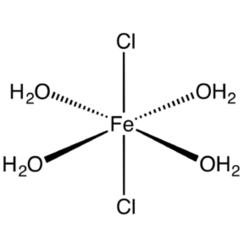
esaidrato: FeCl3.6H2O ha la formula di struttura trans- [Fe (H2O) 4Cl2] Cl.2H2O
FeCl3.2.5H2O ha la formula di struttura cis- [Fe (H2O) 4Cl2] [FeCl4] .H2O.
diidrato: FeCl3.2H2O ha la formula di struttura trans- [Fe (H2O) 4Cl2] [FeCl4].
FeCl3.3.5H2O ha la formula strutturale cis- [FeCl2 (H2O) 4] [FeCl4] .3H2O.
-Soluzione acquosa
Le soluzioni acquose di cloruro ferrico sono tipicamente gialle, in contrasto con le soluzioni rosa pallido di [Fe (H2O) 6] 3+. Secondo misurazioni spettroscopiche, le specie più importanti in soluzioni acquose di cloruro ferrico sono il complesso ottaedrico [FeCl2 (H2O) 4] + (stereochimica non specificata) e il tetraedro [FeCl4] -.
Applicazioni
-Industriale
Il cloruro di ferro (III) viene utilizzato nel trattamento delle acque reflue e nella produzione di acqua potabile come coagulante e flocculante. In questa applicazione, in acqua leggermente basica, il cloruro ferrico reagisce con lo ione idrossido per formare una scaglia di idrossido di ferro (III), o più accuratamente formulato come FeO (OH) -, che può rimuovere i materiali sospesi.
Viene anche utilizzato come agente di lisciviazione nell'idrometallurgia dei cloruri, ad esempio nella produzione di Si da FeSi (processo Silgrain).
Un'altra importante applicazione del cloruro di ferro (III) è l'attacco del rame in una reazione redox in due fasi al cloruro di rame (I) e quindi al cloruro di rame (II) nella produzione di circuiti stampati
Il cloruro di ferro (III) viene utilizzato come catalizzatore per la reazione dell'etilene con il cloro per formare dicloruro di etilene (1,2-dicloroetano), una sostanza chimica importante utilizzata principalmente nella produzione industriale del cloruro di vinile, il monomero per la produzione di PVC.
-Uso di laboratorio
In laboratorio, il cloruro di ferro (III) viene spesso utilizzato come acido di Lewis per catalizzare reazioni come la clorurazione di composti aromatici e la reazione di Friedel-Crafts degli aromatici. È meno potente del cloruro di alluminio, ma in alcuni casi questa morbidezza porta a rese più elevate, ad esempio nell'alchilazione del benzene
Il test del cloruro ferrico è un test colorimetrico tradizionale per i fenoli, utilizzando una soluzione di cloruro di ferro (III) all'1% neutralizzata con idrossido di sodio fino a formare una leggera precipitazione di FeO (OH). La miscela viene filtrata prima dell'uso. La materia organica viene sciolta in acqua, metanolo o etanolo e quindi viene aggiunta la soluzione di cloruro di ferro (III) neutralizzata - uno scolorimento transitorio o permanente (solitamente viola, verde o blu) indica la presenza di un fenolo o enolo.
Questa reazione viene sfruttata nello spot test Trinder, che viene utilizzato per indicare la presenza di salicilati, in particolare acido salicilico, che contiene un gruppo OH fenolico.
Questo test può essere utilizzato per rilevare la presenza di acido gamma-idrossibutirrico e gamma-butirrolattone, facendolo diventare bruno-rossastro.
Altri usi
-Utilizzato anidro come reagente essiccante in alcune reazioni.
-Utilizzato per rilevare la presenza di composti fenolici nella sintesi organica; esaminando, ad esempio, la purezza dell'aspirina sintetizzata.
-Utilizzato nel trattamento delle acque e delle acque reflue per precipitare il fosfato come fosfato di ferro (III).
-Utilizzato nel trattamento delle acque reflue per il controllo degli odori.
-Utilizzato dai collezionisti di monete statunitensi per identificare le date dei pali di Buffalo che sono così consumate che la data non è più visibile.
Utilizzato dai fabbri e dagli artigiani della saldatura di modelli per incidere il metallo, dandogli un effetto di contrasto, per visualizzare strati di metallo o imperfezioni.
-Utilizzato per incidere il modello widmanstatten nei meteoriti di ferro.
-Necessario per incisione su lastre calcografiche per stampa fotografica e visiva