No tiene ningún artículo en su cesta
Fenolftaleína
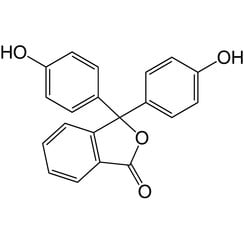
La fenolftaleína es un compuesto químico con la fórmula C20H14O4 y se escribe brevemente como "HIn" o "phph". La fenolftaleína se utiliza a menudo como indicador en valoraciones ácido-base. Para esta aplicación se vuelve incoloro en soluciones ácidas y rosa en soluciones básicas. Pertenece a la clase de tintes conocidos como tintes de ftaleína.
La fenolftaleína es escasamente soluble en agua y generalmente se disuelve en alcoholes para su uso en experimentos. Es un ácido débil que puede perder iones H + en solución. La molécula de fenolftaleína es incolora y el ion fenolftaleína es rosa. Cuando se agrega una base a la fenolftaleína, el equilibrio cambia y conduce a una mayor ionización a medida que se eliminan los iones H +. Esto está predicho por el principio de Le Chatelier.
Aplicaciones
indicador de pH
El uso generalizado de fenolftaleína es un indicador de valoraciones ácido-base. También sirve como componente de indicador universal, junto con rojo de metilo, azul de bromotimol y azul de timol.
La fenolftaleína toma al menos cuatro estados diferentes en solución acuosa debido a los cambios de pH. En condiciones de alta acidez existe en forma protonada (HIn +), lo que le da un color naranja. Entre condiciones fuertemente ácidas y ligeramente básicas, la forma de lactona (HIn) es incolora. La forma fenolato doblemente desprotonada (In2) (la forma aniónica del fenol) da el familiar color rosado. En soluciones muy básicas, la fenolftaleína se convierte en su forma In (OH) 3 y el color rosa sufre una reacción de desvanecimiento bastante lenta y se vuelve completamente incoloro por encima de 13,0 pH.
-Carbonatación de hormigón
La sensibilidad al pH de la fenolftaleina se explota en otras aplicaciones: el hormigón naturalmente tiene un pH alto debido al hidróxido de calcio que se forma cuando el cemento Portland reacciona con el agua. A medida que el hormigón reacciona con el dióxido de carbono de la atmósfera, el pH desciende a 8,5-9. Cuando se aplica una solución de fenolftaleína al 1% al concreto normal, se vuelve rosa brillante. Sin embargo, si permanece incoloro, muestra que el hormigón ha sufrido carbonatación. En una aplicación similar, algunas masillas usadas para reparar agujeros en paneles de yeso contienen fenolftaleína. Durante la aplicación, el material base del envase conserva un color rosa; cuando el masilla se cura por reacción con el dióxido de carbono atmosférico, el color rosa se desvanece.
-Educativo
En una solución muy básica, el lento cambio de la fenolftaleína de rosa a incolora cuando se convierte a su forma In (OH) 3 se utiliza en clases de química para el estudio de la cinética de reacción.
-Entretenimiento
La fenolftaleína se usa en juguetes, como parte de la tinta que desaparece o pintura que desaparece en el cabello de Hollywood Hair Barbie. En la tinta, se mezcla con hidróxido de sodio, que reacciona con el dióxido de carbono del aire. Esta reacción hace que el pH caiga por debajo del umbral de cambio de color cuando se liberan iones de hidrógeno de la reacción:
OH− (aq) + CO2 (g) → CO2−
3 (ac) + H + (ac).
Para desarrollar el cabello y los patrones gráficos "mágicos", se rocía la tinta con una solución de hidróxido, lo que conduce a la aparición de las imágenes ocultas mediante el mismo mecanismo descrito anteriormente para el cambio de color en solución alcalina. La reacción con el dióxido de carbono finalmente hace que el patrón desaparezca. La timolftaleína se usa para el mismo propósito y de la misma manera cuando se desea un color azul.
-Uso médico
La fenolftaleína se ha utilizado como laxante durante más de un siglo, pero ahora se está eliminando de los laxantes de venta libre debido a preocupaciones sobre la carcinogenicidad. Los laxantes que anteriormente contenían fenolftaleína a menudo se han reformulado con ingredientes activos alternativos: Feen-a-Mint cambió a bisacodyl y Ex-Lax cambió a un extracto de sen.
La timolftaleína es un laxante relacionado elaborado a partir de timol.
A pesar de las preocupaciones sobre su carcinogenicidad, es poco probable que el uso de fenolftaleína como laxante cause cáncer de ovario. Se ha descubierto que la fenolftaleína inhibe la entrada de calcio celular humano a través de la entrada de calcio almacenado (SOCE, consulte Activación del canal de liberación de calcio § Estructura). Esto se logra mediante la trombina inhibidora y la tapsigargina, dos activadores de SOCE que aumentan el calcio libre intracelular.
La fenolftaleína se ha agregado a la lista de sustancias candidatas de la Agencia Europea de Sustancias Químicas altamente preocupantes (SVHC). [14]
Una forma reducida de fenolftaleína, fenolftalina, que es incolora, se usa en una prueba para identificar sustancias que se cree que contienen sangre, comúnmente conocida como prueba de Kastle-Meyer. Se recoge una muestra seca con un hisopo de algodón o papel de filtro. Unas gotas de alcohol, luego unas gotas de fenolftalina y finalmente unas gotas de peróxido de hidrógeno cayeron sobre la muestra. Si la muestra contiene hemoglobina, inmediatamente se volverá rosa al agregar el peróxido debido a la formación de fenolftaleína. Una prueba positiva indica que la muestra contiene hemoglobina y, por lo tanto, es probable que sea sangre. Un falso positivo puede resultar de la presencia de sustancias con una actividad catalítica similar a la hemoglobina. Esta prueba no es destructiva para la muestra; se puede guardar y utilizar en más pruebas. Esta prueba tiene la misma reacción con la sangre de cualquier animal cuya sangre contenga hemoglobina, incluidos casi todos los vertebrados; Se necesitarían más pruebas para determinar si era de un humano.
La fenolftaleína se puede preparar condensando anhídrido ftálico con dos equivalentes de fenol en condiciones ácidas (de ahí el nombre). Fue descubierto en 1871 por Adolf von Baeyer.
La reacción también puede ser catalizada por un m