No tiene ningún artículo en su cesta
Luminol
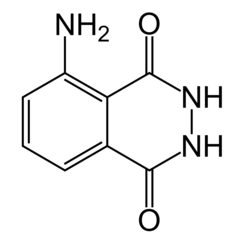
El luminol (C8H7N3O2) es un químico que exhibe quimioluminiscencia con un brillo azul cuando se mezcla con un agente oxidante adecuado. El luminol es un sólido cristalino de color blanco a amarillo pálido que es soluble en la mayoría de los disolventes orgánicos polares, pero insoluble en agua.
Los investigadores forenses utilizan luminol para detectar rastros de sangre en las escenas del crimen porque reacciona con el hierro de la hemoglobina. Los biólogos lo utilizan en ensayos celulares para detectar cobre, hierro, cianuros y proteínas específicas a través de Western Blot.
Cuando el luminol se rocía uniformemente sobre un área, los rastros de un oxidante activador hacen que el luminol emita un brillo azul que se puede ver en una habitación oscura. El brillo solo dura unos 30 segundos, pero los investigadores pueden documentar el efecto con una foto de larga exposición. Los investigadores de la escena del crimen deben aplicarlo de manera uniforme para evitar resultados engañosos, ya que los rastros de sangre parecen más concentrados en las áreas que rocían más. La intensidad del brillo no indica la cantidad de sangre u otro activador presente, solo indica la distribución de esporas en el área.
Para mostrar su luminiscencia, el luminol debe activarse con un agente oxidante. Por lo general, el activador es una solución que contiene peróxido de hidrógeno (H2O2) e iones de hidróxido en agua. En presencia de un catalizador como un compuesto de hierro o peryodato, el peróxido de hidrógeno se descompone para formar oxígeno y agua:
2 H2O2 → O2 + 2 H2O
H2O2 + KIO4 → KIO3 + O2 + H2O
Los entornos de laboratorio a menudo usan ferricianuro de potasio o peryodato de potasio para el catalizador. En la detección forense de sangre, el catalizador es el hierro presente en la hemoglobina. Las enzimas en varios sistemas biológicos también pueden catalizar la descomposición del peróxido de hidrógeno.
El luminol reacciona con el ion hidróxido para formar un dianión. El oxígeno producido a partir del peróxido de hidrógeno reacciona luego con el dianión luminol. El producto de esta reacción, un peróxido orgánico, es muy inestable y se descompone inmediatamente con la pérdida de nitrógeno para producir ácido 5-aminoftálico con electrones excitados. A medida que el estado excitado se relaja al estado fundamental, el exceso de energía se libera como un fotón visible como luz azul.