Il n'y a aucun article dans votre panier
Luminol
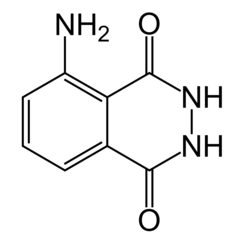
Le luminol (C8H7N3O2) est un produit chimique qui présente une chimioluminescence, avec une lueur bleue lorsqu'il est mélangé avec un agent oxydant approprié. Le luminol est un solide cristallin blanc à jaune pâle qui est soluble dans la plupart des solvants organiques polaires, mais insoluble dans l'eau.
Les enquêteurs légistes utilisent le luminol pour détecter des traces de sang dans les scènes de crime car il réagit avec le fer contenu dans l'hémoglobine. Les biologistes l'utilisent dans des analyses cellulaires pour détecter le cuivre, le fer, les cyanures et des protéines spécifiques par transfert de Western.
Lorsque le luminol est uniformément pulvérisé sur une zone, des traces d'un oxydant activateur font émettre au luminol une lueur bleue qui peut être vue dans une pièce sombre. La lueur ne dure qu'environ 30 secondes, mais les chercheurs peuvent documenter l'effet avec une photo longue exposition. Les enquêteurs sur les lieux du crime doivent l'appliquer uniformément pour éviter des résultats trompeurs, car les traces de sang semblent plus concentrées dans les zones qui pulvérisent davantage. L'intensité de la lueur n'indique pas la quantité de sang ou autre activateur présent, mais indique seulement la distribution des spores dans la zone.
Pour montrer sa luminescence, le luminol doit être activé avec un agent oxydant. Habituellement, une solution contenant du peroxyde d'hydrogène (H2O2) et des ions hydroxyde dans l'eau est l'activateur. En présence d'un catalyseur tel qu'un fer ou un composé de périodate, le peroxyde d'hydrogène se décompose pour former de l'oxygène et de l'eau:
2 H2O2 → O2 + 2 H2O
H2O2 + KIO4 → KIO3 + O2 + H2O
Les environnements de laboratoire utilisent souvent du ferricyanure de potassium ou du périodate de potassium comme catalyseur. Dans la détection médico-légale du sang, le catalyseur est le fer présent dans l'hémoglobine. Les enzymes de divers systèmes biologiques peuvent également catalyser la dégradation du peroxyde d'hydrogène.
Le luminol réagit avec l'ion hydroxyde pour former un dianion. L'oxygène produit à partir du peroxyde d'hydrogène réagit alors avec le luminol dianion. Le produit de cette réaction, un peroxyde organique, est très instable et se décompose immédiatement avec la perte d'azote pour produire de l'acide 5-aminophtalique avec des électrons excités. Lorsque l'état excité se détend à l'état fondamental, l'excès d'énergie est libéré sous forme de photon visible sous forme de lumière bleue