Non ci sono articoli nel tuo carrello
Luminol
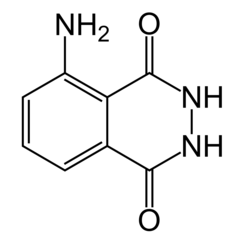
Il luminolo (C8H7N3O2) è una sostanza chimica che mostra chemiluminescenza, con un bagliore blu, se miscelata con un agente ossidante adatto. Il luminolo è un solido cristallino da bianco a giallo pallido che è solubile nella maggior parte dei solventi organici polari, ma insolubile in acqua.
Gli investigatori forensi usano il luminol per rilevare tracce di sangue nelle scene del crimine perché reagisce con il ferro nell'emoglobina. I biologi lo usano nei saggi cellulari per rilevare rame, ferro, cianuri e proteine specifiche tramite western blotting.
Quando il luminol viene spruzzato in modo uniforme su un'area, le tracce di un ossidante attivante fanno sì che il luminol emetta un bagliore blu che può essere visto in una stanza buia. Il bagliore dura solo circa 30 secondi, ma i ricercatori possono documentare l'effetto con una foto a lunga esposizione. Gli investigatori sulla scena del crimine dovrebbero applicarlo in modo uniforme per evitare risultati fuorvianti, poiché le tracce di sangue appaiono più concentrate nelle aree che spruzzano di più. L'intensità del bagliore non indica la quantità di sangue o altro attivatore presente, ma indica solo la distribuzione delle spore nell'area.
Per mostrare la sua luminescenza, il luminolo deve essere attivato con un agente ossidante. Di solito l'attivatore è una soluzione contenente perossido di idrogeno (H2O2) e ioni idrossido in acqua. In presenza di un catalizzatore come un composto di ferro o periodato, il perossido di idrogeno si decompone per formare ossigeno e acqua:
2 H2O2 → O2 + 2 H2O
H2O2 + KIO4 → KIO3 + O2 + H2O
Le impostazioni di laboratorio usano spesso ferricianuro di potassio o periodato di potassio per il catalizzatore. Nella rilevazione forense del sangue, il catalizzatore è il ferro presente nell'emoglobina. Gli enzimi in vari sistemi biologici possono anche catalizzare la degradazione del perossido di idrogeno.
Il luminolo reagisce con lo ione idrossido per formare un dianion. L'ossigeno prodotto dal perossido di idrogeno reagisce quindi con il luminol dianion. Il prodotto di questa reazione, un perossido organico, è molto instabile e si decompone immediatamente con la perdita di azoto per produrre acido 5-amminoftalico con elettroni eccitati. Quando lo stato eccitato si rilassa allo stato fondamentale, l'energia in eccesso viene rilasciata come un fotone visibile come luce blu