Il n'y a aucun article dans votre panier
Chlorure d'aluminium
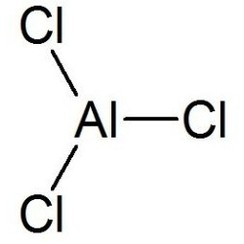
Le chlorure d'aluminium (AlCl3), également connu sous le nom de trichlorure d'aluminium, est le principal composé d'aluminium et de chlore. Il est blanc, mais les échantillons sont souvent contaminés par du chlorure de fer (III), ce qui lui donne une couleur jaune. Le solide a un point de fusion et d'ébullition bas. Il est principalement produit et consommé dans la production d'aluminium métallique, mais de grandes quantités sont également utilisées dans d'autres domaines de l'industrie chimique. Le composé est souvent appelé acide de Lewis. C'est un exemple de composé inorganique qui passe de manière réversible d'un polymère à un monomère à température douce.
Applications
L'AlCl3 est probablement l'acide de Lewis le plus largement utilisé et est également l'un des plus puissants. Il trouve une application dans l'industrie chimique en tant que catalyseur des réactions de Friedel-Crafts, à la fois des acylations et des alkylations. Les produits importants sont les détergents et l'éthylbenzène. Il est également utilisé dans les réactions de polymérisation et d'isomérisation des hydrocarbures.
La réaction de Friedel-Crafts est la principale utilisation du chlorure d'aluminium, par exemple dans la préparation d'anthraquinone (pour l'industrie de la teinture) à partir de benzène et de phosgène. Dans la réaction générale de Friedel-Crafts, un chlorure d'acyle ou un halogénure d'alkyle réagit avec une substance aromatique.
La réaction d'alkylation est plus largement utilisée que la réaction d'acylation, bien que la pratique soit plus exigeante techniquement car la réaction est plus lente. Pour les deux réactions, le chlorure d'aluminium, ainsi que d'autres matériaux et équipements, doivent être secs, bien qu'une trace d'humidité soit nécessaire pour que la réaction se déroule. Un problème courant avec la réaction de Friedel-Crafts est que le catalyseur au chlorure d'aluminium est parfois nécessaire en quantités stoechiométriques complètes car il est très complexe avec les produits. Cette complication produit parfois une grande quantité de déchets corrosifs. Pour ces raisons et des raisons similaires, des catalyseurs plus recyclables ou plus respectueux de l'environnement ont été recherchés. Par exemple, l'utilisation de chlorure d'aluminium est déplacée par les zéolites dans certaines applications.
Le chlorure d'aluminium peut également être utilisé pour introduire des groupes aldéhyde dans des cycles aromatiques, par exemple via la réaction de Gattermann-Koch en utilisant du monoxyde de carbone, du chlorure d'hydrogène et un cocatalyseur de chlorure de cuivre (I).
Le chlorure d'aluminium a une grande variété d'autres utilisations en chimie organique. Par exemple, il peut catalyser la «réaction ène», telle que l'addition de 3-butén-2-one (méthylvinylcétone) à la carvone.
L'AlCl3 est également largement utilisé pour les réactions de polymérisation et d'isomérisation des hydrocarbures. Des exemples importants sont la production d'éthylbenzène, qui sert à fabriquer du styrène et donc du polystyrène, ainsi que la production de dodécylbenzène, qui est utilisé pour fabriquer des détergents.
Le chlorure d'aluminium combiné à l'aluminium en présence d'un arène peut être utilisé pour synthétiser des complexes de bis (arène) métalliques, par ex. le bis (benzène) chrome, de certains halogénures métalliques via la synthèse dite Fischer-Hafner.
Chlorures d'aluminium hydratés
Le dihydrate a peu d'utilisations, mais le chlorhydrate d'aluminium est un ingrédient commun dans les antisudorifiques à de faibles concentrations. Les patients atteints d'hyperhidrose nécessitent une concentration beaucoup plus élevée (12% ou plus), vendue sous des noms de marque comme Driclor.