Il n'y a aucun article dans votre panier
Sulfate d'aluminium
Le sulfate d'aluminium est un composé chimique de formule Al2 (SO4) 3. Il est soluble dans l'eau et est principalement utilisé comme coagulant (favorisant la collision des particules en neutralisant la charge) dans les stations d'épuration d'eau potable et de traitement des eaux usées, ainsi que dans la fabrication du papier.
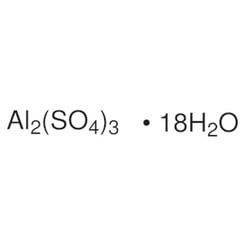
La forme anhydre se présente naturellement sous la forme d'un minéral millosevichite rare, par ex. dans les environnements volcaniques et dans le brûlage des décharges des mines de charbon. Le sulfate d'aluminium est rarement, voire jamais, trouvé sous forme de sel anhydre. Il forme un certain nombre d'hydrates différents, parmi lesquels l'hexadécahydrate Al2 (SO4) 3 • 16H2O et l'octadécahydrate Al2 (SO4) 3 • 18H2O sont les plus courants. L'heptadécahydrate, dont la formule peut s'écrire [Al (H2O) 6] 2 (SO4) 3 • 5H2O, se présente naturellement sous forme d'aluminogène minéral.
Le sulfate d'aluminium est parfois appelé alun dans certaines industries. Cependant, le nom «alun» est utilisé plus souvent et mieux pour tout sel double sulfate de formule générique XAl (SO4) 2 · 12H
2O, où X est un cation monovalent tel que le potassium ou l'ammonium.
Applications
Il est parfois utilisé dans l'industrie alimentaire comme agent raffermissant, où il adopte le numéro E E520, et dans l'alimentation animale comme bactéricide. Le sulfate d'aluminium peut être utilisé comme déodorant, agent liant ou comme agent de pointe pour les plaies de rasage superficielles.
Il s'agit d'un adjuvant de vaccin courant et fonctionne "en facilitant la libération lente de l'antigène du pot de vaccin au site d'inoculation".
Le sulfate d'aluminium est utilisé dans la purification de l'eau et comme mordant dans la teinture et l'impression sur textiles. Dans la purification de l'eau, les impuretés en suspension se coagulent en particules plus grosses, puis se déposent (ou sont filtrées) plus facilement au fond du récipient. Ce processus est appelé coagulation ou floculation. Les recherches indiquent que le sulfate d'aluminium utilisé de cette manière dans le traitement de l'eau potable en Australie est la principale source de sulfure d'hydrogène dans les égouts. Un incident d'application inapproprié et disproportionné en 1988 a contaminé l'approvisionnement en eau de Camelford à Cornwall.
Lorsque le sulfate d'aluminium est dissous dans une grande quantité d'eau neutre ou légèrement alcaline, il se forme un précipité gélatineux d'hydroxyde d'aluminium, Al (OH) 3. Lors de la teinture et de l'impression sur textiles, le précipité gélatineux aide le colorant à adhérer aux fibres du vêtement en rendant le pigment insoluble.
Le sulfate d'aluminium est parfois utilisé pour abaisser le pH de la terre de jardin, car il s'hydrolyse pour former le précipité d'hydroxyde d'aluminium et une solution d'acide sulfurique diluée. Un exemple de ce que la modification du pH du sol peut faire pour les plantes peut être vu lorsque vous regardez Hydrangea macrophylla. Le jardinier peut ajouter du sulfate d'aluminium au sol pour abaisser le pH, ce qui transformera les fleurs de l'hortensia d'une couleur différente (bleu). L'aluminium est ce qui rend les fleurs bleues; à un pH plus élevé, l'aluminium n'est pas disponible pour l'usine.
Dans la construction, il est utilisé comme agent d'étanchéité et accélérateur dans le béton. Une autre utilisation est un agent moussant dans la mousse extinctrice.
Il peut également être très efficace comme répulsif d'escargots, tuant les escargots espagnols.
Les cornichons de triacétate d'aluminium et de sulfacétate d'aluminium peuvent être préparés à partir de sulfate d'aluminium, le produit formé étant déterminé par la quantité d'acétate de plomb (II) utilisée