Il n'y a aucun article dans votre panier
Acétate de cuivre (II)
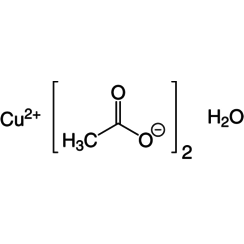
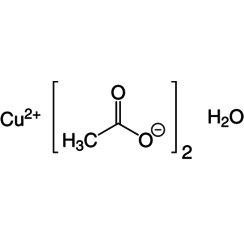
L'acétate de cuivre (II), également appelé acétate cuivrique, est le composé chimique de formule Cu (OAc) 2 où AcO - acétate (CH est 3CO-2). Le dérivé hydraté, qui contient une molécule d'eau pour chaque atome de Cu, est disponible dans le commerce. Le Cu anhydre (OAc) 2 est un solide cristallin vert foncé, tandis que le Cu2 (OAc) 4 (H2O) 2 est plus vert bleuâtre. Depuis l'Antiquité, les acétates de cuivre sont utilisés sous une forme ou une autre comme fongicides et pigments verts. Aujourd'hui, les acétates de cuivre sont utilisés comme réactifs pour la synthèse de divers composés inorganiques et organiques. L'acétate de cuivre, comme tous les composés de cuivre, dégage une lueur bleu-vert dans une flamme. L'hoganite minérale est une forme naturelle d'acétate de cuivre (II).
L'acétate de cuivre (II) a trouvé une certaine utilité comme agent oxydant dans les synthèses organiques. Dans la réaction d'Eglinton, Cu2 (OAc) 4 est utilisé pour coupler les alcynes terminaux en un 1,3-diyne:
Cu2 (OAc) 4 + 2 RC≡CH → 2 CuOAc + RC≡C - C≡CR + 2 HOAc
La réaction se déroule grâce à l'intervention d'acétylures de cuivre (I), qui sont ensuite oxydés par l'acétate de cuivre (II) pour libérer le groupe acétylure. Une réaction connexe avec les acétylures de cuivre est la synthèse de ynamines, alcynes terminaux avec des groupes amine avec Cu2 (OAc) 4. Il a été utilisé pour l'hydroamination de l'acrylonitrile.
C'est également un agent oxydant dans le test Barfoed.
Il se combine avec le trioxyde d'arsenic pour former de l'acétoarsénite de cuivre, un insecticide et fongicide puissant appelé Paris Green ou Schweinfurt Green.