Il n'y a aucun article dans votre panier
Carbonate de cuivre (II)
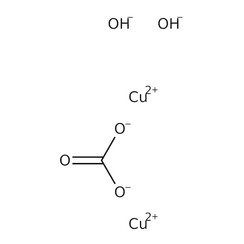
Le carbonate de cuivre (II) ou carbonate de cuivre est un composé chimique de formule CuCO
3. A température ambiante, il s'agit d'un solide ionique (un sel) constitué de cations cuivre (II) Cu2 + et d'anions carbonate CO2−3.
Ce composé est rarement rencontré car il est difficile à préparer et réagit facilement avec l'humidité de l'eau de l'air. Les termes «carbonate de cuivre», «carbonate de cuivre (II)» se réfèrent presque toujours (même dans les textes de chimie) à un carbonate de cuivre basique (ou hydroxyde de carbonate de cuivre (II)), tel que Cu2 (OH) 2CO3 (qui se produit naturellement sous forme de malachite minérale) ou Cu3 (OH) 2 (CO3) 2 (azurite). Pour cette raison, le qualificatif neutre peut être utilisé à la place de «base» pour désigner spécifiquement CuCO3.
La stabilité du CuCO3 sec dépend essentiellement de la pression partielle du dioxyde de carbone (pCO2). Il est stable dans l'air sec pendant des mois, mais se décompose lentement en CuO et CO2 lorsque le pCO2 est inférieur à 0,11 atm.
En présence d'eau ou d'air humide à 25 ° C, le CuCO3 n'est stable qu'au pCO2 au-dessus de 4,57 atmosphères et à un pH compris entre environ 4 et 8. Sous cette pression partielle, il réagit avec l'eau pour former un carbonate basique (azurite, Cu3 (CO3) 2 (OH) 2).