No tiene ningún artículo en su cesta
Peróxido de hidrógeno
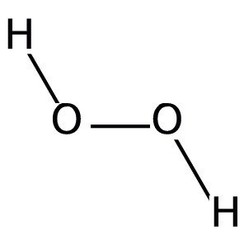
El peróxido de hidrógeno es un compuesto químico con la fórmula H2O2. En su forma pura es un líquido de color azul claro, ligeramente más viscoso que el agua. El peróxido de hidrógeno es el peróxido más simple (un compuesto con un enlace simple oxígeno-oxígeno). Se utiliza como oxidante, blanqueador y antiséptico. El peróxido de hidrógeno concentrado, o "peróxido de alto rendimiento", es una especie de oxígeno reactivo y se ha utilizado como propulsor en cohetes. La química está dominada por la naturaleza del enlace peróxido inestable.
El peróxido de hidrógeno es inestable y se descompone lentamente en presencia de luz. Debido a su inestabilidad, el peróxido de hidrógeno generalmente se almacena con un estabilizador en una solución débilmente ácida en una botella de color oscuro. El peróxido de hidrógeno se encuentra en sistemas biológicos, incluido el cuerpo humano. Las enzimas que usan o descomponen el peróxido de hidrógeno se clasifican como peroxidasas.
Propiedades
El punto de ebullición del H2O2 se ha extrapolado a 150,2 ° C (302,4 ° F), aproximadamente 50 ° C (90 ° F) más alto que el del agua. En la práctica, el peróxido de hidrógeno sufre una descomposición térmica potencialmente explosiva cuando se calienta a esta temperatura. Se puede destilar de forma segura a temperaturas más bajas a presión reducida.
El peróxido de hidrógeno (H2O2) es una molécula no plana con simetría C2 (rotada); esto fue demostrado por primera vez por Paul-Antoine Giguère en 1950 usando espectroscopía infrarroja. Aunque el enlace O-O es un enlace sencillo, la molécula tiene una barrera rotacional relativamente alta de 2460 cm -1 (29,45 kJ / mol); En comparación, la barrera de rotación para el etano es de 1040 cm -1 (12,5 kJ / mol). El aumento de la barrera se atribuye a la repulsión entre los pares solitarios de los átomos de oxígeno adyacentes y da como resultado que el peróxido de hidrógeno presente atropisomería.
Las estructuras moleculares del H2O2 gaseoso y cristalino son significativamente diferentes. Esta diferencia se atribuye a los efectos del enlace de hidrógeno, que está ausente en estado gaseoso. Los cristales de H2O2 son tetragonales con el grupo espacial D44P4121.
Soluciones acuosas
En soluciones acuosas, el peróxido de hidrógeno se diferencia de la sustancia pura debido a los efectos del enlace de hidrógeno entre el agua y las moléculas de peróxido de hidrógeno. El peróxido de hidrógeno y el agua forman una mezcla eutéctica y muestran una depresión del punto de congelación a -56 ° C; el agua pura tiene un punto de congelación de 0 ° C y el peróxido de hidrógeno puro de −0,43 ° C. El punto de ebullición de las mismas mezclas también se reduce con respecto a la media de ambos puntos de ebullición (125,1 ° C). Se produce a 114 ° C. Este punto de ebullición es 14 ° C más alto que el del agua pura y 36,2 ° C más bajo que el del peróxido de hidrógeno puro.
Aplicaciones
- resulta
Aproximadamente el 60% de la producción mundial de peróxido de hidrógeno se utiliza para el blanqueo de pulpa y papel. La segunda aplicación industrial importante es la fabricación de percarbonato de sodio y perborato de sodio, que se utilizan como agentes blanqueadores suaves en los detergentes para ropa. El percarbonato de sodio, un aducto de carbonato de sodio y peróxido de hidrógeno, es el ingrediente activo en productos de lavandería tales como el detergente para ropa OxiClean y Tide. Cuando se disuelve en agua, libera peróxido de hidrógeno y carbonato de sodio. Por sí solos, estos blanqueadores solo son efectivos a temperaturas de lavado de 60 ° C (140 ° F) o más y, por lo tanto, a menudo se usan junto con activadores de blanqueadores, que facilitan la limpieza a temperaturas más bajas.
-Producción de compuestos orgánicos
Se utiliza en la producción de varios peróxidos orgánicos, siendo el peróxido de dibenzoílo un ejemplo de alto volumen. Se utiliza en polimerizaciones, como blanqueador de harinas y como tratamiento para el acné. Los peroxiácidos, como el ácido peracético y el ácido metacloroperoxibenzoico, también se producen con peróxido de hidrógeno.
-Desinfectante
El peróxido de hidrógeno se usa en ciertos procesos de tratamiento de aguas residuales para eliminar impurezas orgánicas. En el proceso de oxidación avanzado, la reacción de Fenton produce el radical hidroxilo (OH) altamente reactivo. Esto degrada los compuestos orgánicos, incluidos los que suelen ser robustos, como los compuestos aromáticos o halogenados. También puede oxidar compuestos que contienen azufre en los desechos; lo cual es beneficioso ya que generalmente reduce su olor.
El peróxido de hidrógeno se puede usar para esterilizar una variedad de superficies, incluidas las herramientas quirúrgicas, y se puede usar como vapor (VHP) para la esterilización de la cámara. El H2O2 tiene un amplio espectro de actividad contra virus, bacterias, levaduras y esporas bacterianas. En general, se observa una mayor actividad contra las bacterias Gram positivas que contra las Gram negativas; sin embargo, la presencia de catalasa u otras peroxidasas en estos organismos puede aumentar la tolerancia en presencia de concentraciones más bajas. Los niveles de concentración más bajos (3%) actúan contra la mayoría de las esporas; concentraciones más altas (7 a 30%) y tiempos de contacto más prolongados mejorarán la actividad destructora de esporas.
El peróxido de hidrógeno se considera una alternativa ecológica a los blanqueadores a base de cloro porque se descompone en oxígeno y agua y es ampliamente reconocido como un antimicrobiano seguro en los Estados Unidos. Administración de Alimentos y Medicamentos (FDA).
El peróxido de hidrógeno se puede usar para tratar el acné, aunque el peróxido de benzoilo es un tratamiento más común.
-Usos de nicho
El peróxido de hidrógeno tiene varios usos domésticos, principalmente como agente de limpieza y desinfección.
Decoloración del cabello
Se ha utilizado H2O2 diluido (entre 1,9% y 12%) mezclado con amoniaco acuoso para blanquear el cabello humano. La propiedad blanqueadora del químico da nombre al término "peróxido rubio". El peróxido de hidrógeno también se usa para blanquear los dientes. Se puede encontrar en la mayoría de las pastas dentales blanqueadoras. El peróxido de hidrógeno ha mostrado resultados positivos en cuanto a la luminosidad de los dientes y los colores cromáticos. Actúa oxidando los pigmentos de color en el esmalte donde el color del diente puede aclararse. El peróxido de hidrógeno se puede mezclar con bicarbonato de sodio y sal para hacer una pasta de dientes casera.
-Luces químicas
El peróxido de hidrógeno reacciona con ciertos diésteres, como el éster de oxalato de fenilo (cialume), para producir quimioluminiscencia; esta aplicación es más común en forma de barras luminosas.
Horticultura
Algunos jardineros y usuarios de hidroponía recomiendan el uso de una solución de peróxido de hidrógeno débil en soluciones de agua. La descomposición espontánea libera oxígeno que promueve el desarrollo de la raíz de una planta y ayuda a tratar la pudrición de la raíz (muerte celular de la raíz por falta de oxígeno) y una variedad de otras plagas.
-Pescado
El peróxido de hidrógeno se usa en acuicultura para controlar la mortalidad causada por varios microbios. En 2019, la FDA de los Estados Unidos lo aprobó para el control de la saprolegniasis en todos los peces de agua fría y todos los peces juveniles y adultos de agua fría y tibia, para el control de la enfermedad columnar externa en peces de aguas cálidas y para el control de Gyrodactylus spp. en salmónidos cultivados en agua dulce. Las pruebas de laboratorio realizadas por los piscicultores han demostrado que el peróxido de hidrógeno doméstico común se puede utilizar de forma segura para oxigenar peces pequeños. El peróxido de hidrógeno libera oxígeno a través de la descomposición cuando se expone a catalizadores como el dióxido de manganeso.