U heeft geen artikelen in uw winkelwagen
Waterstofperoxide
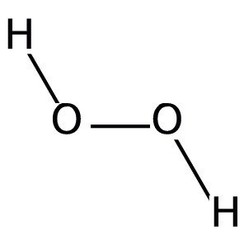
Waterstofperoxide is een chemische verbinding met de formule H2O2. In pure vorm is het een lichtblauwe vloeistof, iets stroperiger dan water. Waterstofperoxide is het eenvoudigste peroxide (een verbinding met een zuurstof-zuurstof enkele binding). Het wordt gebruikt als oxidatiemiddel, bleekmiddel en antisepticum. Geconcentreerd waterstofperoxide, of "high-test peroxide", is een reactieve zuurstofsoort en is gebruikt als drijfgas in raketten. De chemie wordt gedomineerd door de aard van de onstabiele peroxidebinding.
Waterstofperoxide is onstabiel en ontleedt langzaam in aanwezigheid van licht. Vanwege de instabiliteit wordt waterstofperoxide meestal opgeslagen met een stabilisator in een zwak zure oplossing in een donker gekleurde fles. Waterstofperoxide wordt aangetroffen in biologische systemen, waaronder het menselijk lichaam. Enzymen die waterstofperoxide gebruiken of ontleden, worden geclassificeerd als peroxidasen.
Eigendommen
Het kookpunt van H2O2 is geëxtrapoleerd als zijnde 150,2 ° C (302,4 ° F), ongeveer 50 ° C (90 ° F) hoger dan water. In de praktijk ondergaat waterstofperoxide bij verhitting tot deze temperatuur een potentieel explosieve thermische ontleding. Het kan veilig worden gedistilleerd bij lagere temperaturen onder verminderde druk.
Waterstofperoxide (H2O2) is een niet-vlak molecuul met (gedraaide) C2-symmetrie; dit werd voor het eerst aangetoond door Paul-Antoine Giguère in 1950 met behulp van infraroodspectroscopie. Hoewel de O-O-binding een enkele binding is, heeft het molecuul een relatief hoge rotatiebarrière van 2460 cm - 1 (29,45 kJ / mol); ter vergelijking: de rotatiebarrière voor ethaan is 1040 cm - 1 (12,5 kJ / mol). De verhoogde barrière wordt toegeschreven aan afstoting tussen de eenzame paren van de aangrenzende zuurstofatomen en resulteert in waterstofperoxide dat atropisomerisme vertoont.
De moleculaire structuren van gasvormig en kristallijn H2O2 zijn significant verschillend. Dit verschil wordt toegeschreven aan de effecten van waterstofbinding, die in gasvormige toestand afwezig is. Kristallen van H2O2 zijn tetragonaal met de ruimtegroep D44P4121.
Waterige oplossingen
In waterige oplossingen verschilt waterstofperoxide van de zuivere stof vanwege de effecten van waterstofbinding tussen water en waterstofperoxidemoleculen. Waterstofperoxide en water vormen een eutectisch mengsel en vertonen een vriespuntverlaging tot -56 ° C; zuiver water heeft een vriespunt van 0 ° C en zuiver waterstofperoxide van −0,43 ° C. Het kookpunt van dezelfde mengsels wordt ook verlaagd ten opzichte van het gemiddelde van beide kookpunten (125,1 ° C). Het komt voor bij 114 ° C. Dit kookpunt is 14 ° C hoger dan dat van zuiver water en 36,2 ° C lager dan dat van zuiver waterstofperoxide.
Toepassingen
-Bleken
Ongeveer 60% van de wereldproductie van waterstofperoxide wordt gebruikt voor het bleken van pulp en papier. De tweede grote industriële toepassing is de vervaardiging van natriumpercarbonaat en natriumperboraat, die worden gebruikt als milde bleekmiddelen in wasmiddelen. Natriumpercarbonaat, een adduct van natriumcarbonaat en waterstofperoxide, is het actieve ingrediënt in dergelijke wasproducten als OxiClean en Tide-wasmiddel. Wanneer opgelost in water, geeft het waterstofperoxide en natriumcarbonaat af. Op zichzelf zijn deze bleekmiddelen alleen effectief bij wastemperaturen van 60 ° C (140 ° F) of hoger en worden daarom vaak gebruikt in combinatie met bleekactivatoren, die het schoonmaken bij lagere temperaturen vergemakkelijken.
-Productie van organische verbindingen
Het wordt gebruikt bij de productie van verschillende organische peroxiden, waarbij dibenzoylperoxide een voorbeeld is met een hoog volume. Het wordt gebruikt bij polymerisaties, als bleekmiddel voor meel en als behandeling voor acne. Peroxyzuren, zoals perazijnzuur en meta-chloorperoxybenzoëzuur, worden ook geproduceerd met waterstofperoxide.
-Ontsmettingsmiddel
Waterstofperoxide wordt in bepaalde afvalwaterzuiveringsprocessen gebruikt om organische onzuiverheden te verwijderen. Bij geavanceerde oxidatieverwerking geeft de Fenton-reactie het zeer reactieve hydroxylradicaal (· OH). Hierdoor worden organische verbindingen afgebroken, inclusief die welke gewoonlijk robuust zijn, zoals aromatische of gehalogeneerde verbindingen. Het kan ook zwavelhoudende verbindingen in het afval oxideren; wat gunstig is omdat het over het algemeen hun geur vermindert.
Waterstofperoxide kan worden gebruikt voor de sterilisatie van verschillende oppervlakken, inclusief chirurgisch gereedschap, en kan worden ingezet als damp (VHP) voor sterilisatie in de kamer. H2O2 heeft een breed spectrum aan werkzaamheid tegen virussen, bacteriën, gisten en bacteriële sporen. Over het algemeen wordt een grotere activiteit gezien tegen Gram-positieve dan Gram-negatieve bacteriën; de aanwezigheid van catalase of andere peroxidasen in deze organismen kan de tolerantie echter verhogen in aanwezigheid van lagere concentraties. Lagere concentratieniveaus (3%) werken tegen de meeste sporen; hogere concentraties (7 tot 30%) en langere contacttijden zullen de sporendodende activiteit verbeteren.
Waterstofperoxide wordt gezien als een milieuvriendelijk alternatief voor bleekmiddelen op chloorbasis, omdat het afbreekt tot zuurstof en water en het algemeen wordt erkend als een veilig antimicrobieel middel door de Verenigde Staten. Food and Drug Administration (FDA).
Waterstofperoxide kan worden gebruikt om acne te behandelen, hoewel benzoylperoxide een meer gebruikelijke behandeling is.
-Niche gebruikt
Waterstofperoxide heeft verschillende huishoudelijke toepassingen, voornamelijk als reinigings- en desinfectiemiddel.
-Haar bleken
Verdund H2O2 (tussen 1,9% en 12%) gemengd met waterige ammoniak is gebruikt om mensenhaar te bleken. De blekende eigenschap van de chemische stof geeft zijn naam aan de uitdrukking "blonde peroxide". Waterstofperoxide wordt ook gebruikt voor het bleken van tanden. Het kan worden gevonden in de meeste wittende tandpasta's. Waterstofperoxide heeft positieve resultaten opgeleverd met betrekking tot de lichtheid van de tanden en chromakleuren. Het werkt door gekleurde pigmenten te oxideren op het glazuur waar de kleur van de tand lichter kan worden. Waterstofperoxide kan worden gemengd met zuiveringszout en zout om een zelfgemaakte tandpasta te maken.
-Glow sticks
Waterstofperoxide reageert met bepaalde di-esters, zoals fenyloxalaatester (cyalume), om chemiluminescentie te produceren; deze toepassing komt het meest voor in de vorm van glowsticks.
-Tuinbouw
Sommige tuinders en gebruikers van hydrocultuur pleiten voor het gebruik van een zwakke waterstofperoxide-oplossing in wateroplossingen. Door de spontane afbraak komt zuurstof vrij die de wortelontwikkeling van een plant bevordert en helpt bij het behandelen van wortelrot (cellulaire wortelsterfte door gebrek aan zuurstof) en een verscheidenheid aan andere plagen.
-Fishkeeping
Waterstofperoxide wordt in de aquacultuur gebruikt voor het beheersen van sterfte veroorzaakt door verschillende microben. In 2019 hebben de Verenigde Staten FDA keurde het goed voor de bestrijding van saprolegniase in alle koudwatervissen en alle jonge vissen en volwassen koelwater- en warmwatervissen, voor de bestrijding van uitwendige columnarisziekte bij warmwatervissen en voor de bestrijding van Gyrodactylus spp. in zoetwaterkweek zalmachtigen. Laboratoriumtests uitgevoerd door visteeltkwekers hebben aangetoond dat gewoon huishoudelijk waterstofperoxide veilig kan worden gebruikt om kleine vissen van zuurstof te voorzien. Het waterstofperoxide geeft zuurstof af door ontleding wanneer het wordt blootgesteld aan katalysatoren zoals mangaandioxide.