Keine Artikel in Ihrem Warenkorb
Wasserstoffperoxid
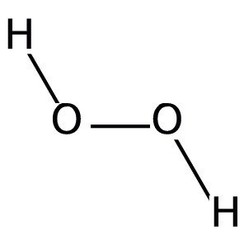
Wasserstoffperoxid (H2O2) ist eine blassblaue, in verdünnter Form farblose, weitgehend stabile Flüssigverbindung aus Wasserstoff und Sauerstoff. Es ist etwas viskoser als Wasser, eine schwache Säure und gegenüber den meisten Stoffen ein sehr starkes Oxidationsmittel, das als solches heftig mit Substanzen wie etwa Kupfer, Messing, Kaliumiodid reagiert und somit als starkes Bleich- und Desinfektionsmittel fungiert. In hochkonzentrierter Form ist es sowohl als Einzel- als auch als Komponentenraketentreibstoff einsetzbar.
In den gewerblichen Handel kommt Wasserstoffperoxid meist als 30 bis 35-prozentige wässrige Lösung.
Verwendung
Hochkonzentrierte Lösungen von Wasserstoffperoxid können sich spontan unter Explosion zersetzen, daher sind im Handel maximal 12-prozentige Lösungen in Wasser frei erhältlich. Ab einer Konzentration von 12 % besteht ein Abgabeverbot an private Endverbraucher; es besteht zudem in Deutschland bei verdächtigen Transaktionen oder Diebstahl Meldepflicht an das zuständige Landeskriminalamt. Für den Industriebedarf gibt es wässrige Lösungen mit Konzentrationen von bis zu 70 % H2O2.
Bleichmittel
Wasserstoffperoxid ist ein Bleichmittel. Weltweit die häufigste Anwendung ist das Bleichen von Zellstoff. Zellstoff wird aus Holz gewonnen, und das enthaltene Lignin gibt dem Zellstoff einen Gilbton, der bei der Hauptverwendung von Zellstoff für Papier und Papiererzeugnisse als störend empfunden wird.
Im Handwerk werden Hölzer bei der Restaurierung oder der Renovierung mit Wasserstoffperoxid gebleicht und dadurch aufgehellt.
Es kommt beim Blondieren sowie Färben, Tönen und Intensivtönen und zur Fixierung dauerhafter Umformungen (Dauerwelle und Volumenwelle) sowie zum Fixieren permanenter Glättung von Haaren zum Einsatz. Ein sehr heller, künstlicher Blondton wird daher „wasserstoffblond“ genannt. Noch deutlicher wird der Zusammenhang in der englischen Bezeichnung peroxide blonde.
In der Zahnmedizin wird es in unterschiedlichen Konzentrationen zum Bleichen von Zähnen verwendet.
Häufig wird es als an Carbamid gebundenes Peroxid eingesetzt.
Wasserstoffperoxid und wasserstoffperoxidhaltige Bleichmittel, wie etwa ein Peroxyessigsäure-Wasserstoffperoxid-Gemisch, werden in der Werbesprache auch mit dem Kunstwort „Aktiv-Sauerstoff“ bezeichnet. Außer dem Wasserstoffperoxid kommen für Bleichzwecke auch andere Peroxide in Frage, die beim Zutritt von Wasser zerfallen und den aktiven atomaren Sauerstoff abgeben.
Auch bei der Tierpräparation wird es verwendet, um bei Tierschädeln den Knochen weiß zu bleichen.
Wasseraufbereitung
Bei der Einwirkung von UV-Strahlen auf Wasserstoffperoxid wird das Hydroxyl-Radikal, ein wesentlich stärkeres Oxidationsmittel als das Peroxid selbst, gebildet. Nachfolgend die Gleichung für die Bildung:
Diese starke Oxidationswirkung wird in der Wasseraufbereitung zum Abbau organischer Verunreinigungen verwendet. Als Beispiel das sogenannte UVOX-Verfahren (UV-Licht und OXidation), mit dem das Herbizid Atrazin und sein Abbauprodukt Desethylatrazin oder auch andere toxische Inhaltsstoffe aus dem Trinkwasser sicher entfernt werden können. Durch diese „nasse Verbrennung“ des Atrazin werden nur Abbauprodukte wie Wasser, Sauerstoff, Kohlenstoffdioxid und Stickstoff gebildet, und es tritt keine zusätzliche Aufsalzung des Wassers auf. Zudem ersetzt diese Methode die Verwendung von Aktivkohle, die deutlich kostenintensiver ist.
Desinfektion und Sterilisation
Eine 3-prozentige Lösung Wasserstoffperoxid wird zur Desinfektion, auch im Haushaltsbereich, eingesetzt. Einsatzbeispiele sind Mund- und Rachenraum (zur Mundspülung wird es auf 0,3 % verdünnt), die Zahnmedizin, die Desinfektion von Kontaktlinsen in Reinigern, die Entkeimung von Packstoffen oder die Desinfektion der Hände in Krankheitsfällen. Demgemäß kommt es in Gesichtscremes zum Einsatz: zur Reinigung der Poren und der Bekämpfung von Pickeln und Hautverunreinigungen. Auch bei der Reinigung von industriellen Abwässern und in der Schwimmbadtechnik erfolgt damit die Desinfektion des Wassers.
Die 35-prozentige Lösung von Wasserstoffperoxid wird in der Lebensmittelindustrie in aseptischen Abfüllanlagen zur Sterilisation von PET-Flaschen, Kunststoffbehältern und den typischen mehrschichtigen Kartonverpackungen verwendet. Zahlreiche Lebensmittel (Getränke, Milch, Milchprodukte, Soßen, Suppen) werden heute zur besseren Haltbarkeit und Produktqualität in Kartons, Becher, Flaschen und Folien aseptisch abgepackt. Dabei wird das Verpackungsmaterial mit 35-prozentigem Wasserstoffperoxid desinfiziert, bevor das jeweilige Lebensmittel eingefüllt wird.
Ein weiteres Anwendungsgebiet ist der Einsatz von gasförmigem H2O2 zur Reinraumdekontamination. Dazu wird eine üblicherweise 35-prozentige Lösung in einem speziellen Apparat verdampft und in den zu dekontaminierenden Bereich (Raum, Kammer usw.) geblasen.
Die hohe bakterizide Wirkung von H2O2, die Umweltverträglichkeit und die gute technische Realisierbarkeit sind die Gründe für die weite Verbreitung dieses Verfahrens.
Ein anderes Verfahren zur Raumdesinfektion mit Wasserstoffperoxid stellt die Kaltverneblung dar. Dabei wird Wasserstoffperoxid in ein Aerosol überführt und je nach Konzentration (ab 3 %) nach einem festgelegten Prozesszyklus durch einen Aerosolerzeuger im Raum verteilt. Die Aerosole haben eine Tröpfchengröße von 0,5–40 µm. Die Tröpfchengröße ist abhängig von der eingesetzten Technologie zur Generation der Aerosole. Die Aerosole verteilen sich nach kurzer Zeit gleichmäßig im Raum. Eine geringe Tröpfchengröße wirkst sich positiv auf die Verteilung und die Schwebefähigkeit der Tröpfchen aus. Je nach klimatischen Ausgangsbedingungen des Raumes wird ein Teil der in flüssiger Phase vorliegenden Tröpfchen in die Gasphase überführt. Die dazu notwendige Energie wird der Raumtemperatur entnommen. Der Prozess ist identisch zur adiabaten Befeuchtung. Das Medium durchmischt sich mit dem Medium Luft und bewirkt bei fachgerechter Anwendung eine holotische Desinfektion. Die Apparatur (Generator) zur Verneblung sowie das spezielle Verfahren müssen im Vorfeld zur Wirksamkeit validiert werden. Darüber hinaus ist diese auf Basis vorliegender Normung auf Wirksamkeit zu überprüfen. Hierbei wird das System aus Desinfektionsprodukt und Aerosolerzeuger in einem Labor auf seine Wirksamkeit getestet.
Sauerstoffzuführung
Wasserstoffperoxid kann in Aquarien zum Zuführen von Sauerstoff benutzt werden. Die Sauerstofferzeugung geschieht in einem Oxidator. Dazu wird in einem Gefäß im Aquarium Wasserstoffperoxid mit Hilfe eines Katalysators in Wasser und Sauerstoffradikale gespaltet.
Gegen Schimmelbefall
Bei der Innenrenovierung kann Schimmelpilzbefall mit Wasserstoffperoxid bekämpft werden. Dabei wirkt es desinfizierend sowohl gegen die biologisch aktiven Pilzzellen – als Fungizid – als auch gegen die „Konidien“ genannten Sporen der Schimmelpilze.
Durch die bleichende Wirkung entfernt es auch „optisch“ die Rückstände des Schimmelbelags von porösen Untergründen. Wasserstoffperoxid hat gegenüber Alkohol oder Chlorbleichlauge einige Vorteile, da es im Gegensatz zu Alkohol unbrennbar ist, bleichende Wirkung hat und im Gegensatz zu Chlorbleichlauge keine chlorierten Nebenprodukte hinterlässt.
Medizin
In der Zahnmedizin wird H2O2 als dreiprozentige wässrige Lösung zur lokalen Desinfektion des Zahngewebes und zur Blutstillung bei kleineren Eingriffen verwendet. In der Medizin und Notfallmedizin kann die Substanz zur Desinfektion von Oberflächen, Instrumenten, Haut und Schleimhaut verwendet werden. Bei der Reinigung von Wunden kommt Wasserstoffperoxid heutzutage zwar noch vereinzelt zum Einsatz, hat aber seine traditionell bedingte Bedeutung inzwischen verloren, denn es wird innerhalb der Wunde bei Kontakt mit roten Blutkörperchen unter Aufschäumen schnell inaktiviert und entfaltet daher seine Wirkung nur kurz.
Seit geraumer Zeit wird ein Verfahren zum Sterilisieren von bestimmten Medizinprodukten und chirurgischen Instrumenten angewandt, in dem H2O2 als Prozesschemikalie Verwendung findet (H2O2-Plasmaverfahren). Besonders bei thermolabilen Produkten bringt es Vorteile gegenüber der Dampfsterilisation. Es kann z. B. im Vakuum bei Raumtemperatur verdampft und zusätzlich ionisiert werden.
Zudem wird H2O2 zur Desinfektion von Piercings verwendet. Dort soll es die betroffene Stelle desinfizieren und eine mögliche Blutung gerinnen lassen, wodurch ein schnellerer Heilprozess eintreten soll.
Landwirtschaft
In der Landwirtschaft wird Wasserstoffperoxid zur Desinfektion in Gewächshäusern und zur Sauerstoffanreicherung in Nährlösungen von Hydrokulturen benutzt. Wasserstoffperoxid wird auch zur Desinfektion von Tränkeleitungssystemen oder Stalleinrichtungen zum Beispiel in der Schweinehaltung verwendet.
Biologie
Für die Bestimmung von Bakterienkulturen wird der Katalase-Test mit dreiprozentiger Wasserstoffperoxidlösung durchgeführt. Die meisten aeroben und fakultativ anaeroben Bakterien wie auch Pilze haben das Enzym Katalase, das imstande ist, das für die Zellen giftige H2O2 zu spalten.
Experimentell wird Wasserstoffperoxid in der Biologie zur Herbeiführung des programmierten Zelltodes von isolierten eukaryotischen Zellen genutzt.
Forensik
Wasserstoffperoxid wurde in der Forensik zum Nachweis von Blut verwendet. Louis Jacques Thénard entdeckte 1818, dass Hämoglobin Wasserstoffperoxid zersetzt. Christian Friedrich Schönbein entwickelte daraus 1863 einen Test auf Blut. Heute wird jedoch der empfindlichere Kastle-Meyer-Test zum Nachweis von Blut verwendet.
Ätzmittel
In der Mikroelektronik benutzt man das Gemisch von Schwefelsäure und Wasserstoffperoxid – „Piranha“ genannt – zur Reinigung der Oberfläche von Wafern und zur Erzeugung einer dünnen, etwa drei bis vier Nanometer dicken hydrophilen Oxidschicht auf den Wafern. Heutzutage ist die Bezeichnung „SPM“ (Sulfuric Peroxide Mixture) geläufiger. Die Hauptanwendung ist das Entfernen von Fotolacken auf Wafern.
Bei der Herstellung von gedruckten Leiterplatten (Platinen) werden konzentrierte Wasserstoffperoxid-haltige Kupferchlorid-Ätzbäder zum Entfernen des Kupfers verwendet:
- .
- Elementares Kupfer reagiert mit Kupfer(II)-chlorid zu Kupfer(I)-chlorid. Es handelt sich hierbei um eine Komproportionierung.
Zur Regeneration der Kupferchlorid-Ätzbäder wird Wasserstoffperoxid zusammen mit Salzsäure eingesetzt:
- .
- Durch Reaktion des Kupfer(I)-chlorid mit Wasserstoffperoxid und Salzsäure wird das Kupfer(II)-chlorid regeneriert. Das Kupferatom wird dabei oxidiert.
Dabei werden die Wasserstoffperoxid- und Salzsäurezugabe über das Redoxpotential gesteuert; die hier verwendeten Fotolacke sind stabil gegen Wasserstoffperoxid.