Il n'y a aucun article dans votre panier
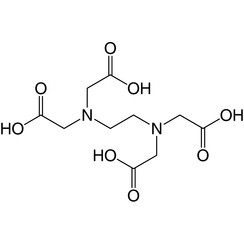
Acide éthylènediaminetétraacétique (EDTA)
L'acide éthylènediaminetétraacétique (EDTA), également connu sous plusieurs autres noms, est un produit chimique utilisé à des fins industrielles et médicales. Il a été synthétisé pour la première fois en 1935 par Ferdinand Münz.
C'est un acide aminopolycarboxylique et un solide soluble dans l'eau incolore. La base conjuguée est l'éthylènediaminetétraacétate. Il est largement utilisé pour dissoudre le calcaire. Son utilité découle de son rôle de ligand hexadentate («six positions») et d'agent chélatant, c'est-à-dire de sa capacité à fixer des ions métalliques tels que Ca2 + et Fe3 +. Après avoir été liés dans un complexe métallique par l'EDTA, les ions métalliques restent en solution mais présentent une réactivité réduite. L'EDTA est produit sous forme de divers sels, notamment l'EDTA disodique, l'EDTA disodique de calcium et l'EDTA tétrasodique (généralement sous forme d'hydrate).
Applications
-Industrie
Dans l'industrie, l'EDTA est principalement utilisé pour stocker les ions métalliques en solution aqueuse. Dans l'industrie textile, il empêche les contaminants ioniques métalliques d'altérer les couleurs des produits teints. Dans l'industrie des pâtes et papiers, l'EDTA inhibe la capacité des ions métalliques, en particulier Mn2 +, à catalyser la disproportionation du peroxyde d'hydrogène, qui est utilisé dans le blanchiment sans chlore. De même, l'EDTA est ajouté à certains aliments comme conservateur ou stabilisant pour empêcher la décoloration oxydante catalytique, qui est catalysée par des ions métalliques. Dans les boissons gazeuses contenant de l'acide ascorbique et du benzoate de sodium, l'EDTA réduit la formation de benzène (un cancérigène).
La réduction de la dureté de l'eau dans les applications de lavage et la dissolution des dépôts de tartre dans les chaudières reposent toutes deux sur l'EDTA et les complexants associés pour lier le Ca2 +, le Mg2 + et d'autres ions métalliques. Une fois liés à l'EDTA, ces centres métalliques ont tendance à ne pas précipiter ni interférer avec l'action des savons et des détergents. Pour des raisons similaires, les solutions de nettoyage contiennent souvent de l'EDTA. De la même manière, l'EDTA est utilisé dans l'industrie du ciment pour la détermination de la chaux libre et de la magnésie libre dans le ciment et le clinker.
La solubilité des ions Fe3 + à ou en dessous d'un pH proche de la neutralité peut être obtenue avec l'EDTA. Cette propriété est utile dans l'agriculture, y compris la culture hydroponique. Cependant, étant donné sa dépendance du pH à la formation du ligand, l'EDTA n'est pas utile pour améliorer la solubilité du fer dans les sols ci-dessus neutres. Sinon, le fer (III) à un pH presque neutre et à un pH supérieur forme des sels insolubles, qui sont moins biodisponibles pour les espèces végétales sensibles. [Fe (EDTA)] aqueux - est utilisé pour éliminer («épurer») le sulfure d'hydrogène des courants gazeux. Cette conversion est obtenue en oxydant le sulfure d'hydrogène en soufre élémentaire, qui est non volatil:
2 [Fe (EDTA)] - + H2S → 2 [Fe (EDTA)] 2− + S + 2 H +
Dans cette application, le centre du fer (III) est réduit en son dérivé du fer (II), qui peut ensuite être réoxydé par l'air. De la même manière, les oxydes d'azote sont éliminés des flux gazeux avec [Fe (edta)] 2−. Les propriétés oxydantes du [Fe (edta)] - sont également exploitées en photographie, où il est utilisé pour dissoudre les particules d'argent.
L'EDTA a été utilisé dans la séparation des métaux lanthanides par chromatographie d'échange d'ions. Mise au point par F. H. Spedding et al. En 1954, la méthode repose sur l'augmentation régulière de la constante de stabilité des complexes lanthanides EDTA de numéro atomique. En utilisant des billes de polystyrène sulfoné et du Cu2 + comme ion de rétention, l'EDTA fait migrer les lanthanides le long de la colonne de résine lorsqu'ils se séparent en bandes de lanthanides purs. Les lanthanides sont élues par ordre de numéro atomique décroissant. En raison du coût de cette méthode, par rapport à l'extraction à contre-courant, l'échange d'ions n'est désormais utilisé que pour obtenir la plus grande pureté des lanthanides (généralement supérieure à 99,99%).
-Médicament
Un sel spécifique d'EDTA, connu sous le nom d'édétate de sodium et de calcium, est utilisé pour lier les ions métalliques dans la pratique de la thérapie par chélation, comme pour le traitement du mercure et de l'intoxication par le plomb. Il est utilisé de la même manière pour éliminer l'excès de fer du corps. Cette thérapie est utilisée pour traiter la complication des transfusions sanguines répétées comme cela serait utilisé pour traiter la thalassémie.
Les dentistes et les endodontistes utilisent des solutions EDTA pour éliminer la saleté inorganique (couche de frottis) et lubrifier les canaux radiculaires en endodontie. Cette procédure aide à préparer les canaux radiculaires pour l'obturation. De plus, avec l'ajout d'un tensioactif, les solutions EDTA relâchent la calcification dans un canal radiculaire et permettent une instrumentation (canalisation) et facilitent la progression apicale d'une lime dans un canal radiculaire serré ou calcifié jusqu'à l'apex.
Il sert de conservateur (généralement pour renforcer l'action d'un autre conservateur tel que le chlorure de benzalkonium ou le thiomersal) dans les préparations pour les yeux et les collyres.
Dans l'évaluation de la fonction rénale, le complexe de chrome (III) [Cr (edta)] - (sous forme de chrome radioactif 51 (51Cr)) est administré par voie intraveineuse et sa filtration dans l'urine est surveillée. Cette méthode est utile pour évaluer le taux de filtration glomérulaire (DFG) en médecine nucléaire.
L'EDTA est largement utilisé dans l'analyse du sang. C'est un anticoagulant pour échantillon sanguin pour les CBC / FBE, où l'EDTA chélate le calcium dans l'échantillon sanguin, arrête le processus de coagulation et maintient la morphologie des cellules sanguines. Les tubes avec EDTA sont marqués de boutons de lavande ou roses. L'EDTA est également disponible dans les tubes tan top pour les tests de plomb et peut être utilisé dans les tubes supérieurs bleu royal pour les tests de métaux traces.
L'EDTA est un dispersant de mucus et s'est avéré très efficace pour réduire la croissance bactérienne lors de l'implantation de lentilles intraoculaires (LIO).
Médecine douce
Certains praticiens alternatifs croient que l'EDTA agit comme un antioxydant et empêche les radicaux libres d'endommager les parois des vaisseaux sanguins, réduisant ainsi l'athérosclérose. Ces idées ne sont pas étayées par des études scientifiques et semblent contredire certains principes actuellement acceptés. La FDA américaine ne l'a pas approuvé pour le traitement de l'athérosclérose.
-Produits de beauté
Dans les shampooings, nettoyants et autres produits de soins personnels, les sels EDTA sont utilisés comme séquestrant pour améliorer leur stabilité dans l'air.
-Applications de laboratoire
En laboratoire, l'EDTA est largement utilisé pour le piégeage des ions métalliques: en biochimie et en biologie moléculaire, la déplétion ionique est souvent utilisée pour désactiver les enzymes dépendant des métaux, soit pour tester leur réactivité, soit pour supprimer les dommages à l'ADN, aux protéines et aux polysaccharides. L'EDTA agit également comme un inhibiteur sélectif contre les enzymes d'hydrolyse du dNTP (Taq polymérase, dUTPase, MutT), l'arginase hépatique et la peroxydase de raifort indépendamment de la chélation des ions métalliques. Ces résultats incitent à reconsidérer l'utilisation de l'EDTA comme piégeur d'ions métalliques biochimiquement inactif dans les expériences enzymatiques. En chimie analytique, l'EDTA est utilisé dans les titrages complexométriques et l'analyse de la dureté de l'eau ou comme agent de masquage pour isoler les ions métalliques qui interféreraient avec les analyses.
L'EDTA a de nombreuses applications spécialisées dans les laboratoires biomédicaux tels que l'ophtalmologie vétérinaire en tant qu'anticollagénase pour prévenir l'aggravation des ulcères cornéens chez les animaux. En culture tissulaire, l'EDTA est utilisé comme agent chélatant qui se lie au calcium et empêche la fixation des cadhérines entre les cellules, empêche l'agglutination des cellules cultivées en suspension liquide ou détache les cellules adhérentes pour qu'elles passent. En histopathologie, l'EDTA peut être utilisé comme agent détartrant, permettant de découper des coupes avec un microtome une fois que l'échantillon de tissu a été déminéralisé. L'EDTA est également connu pour inhiber une gamme de métallopeptidases, le procédé d'inhibition se produit par la chélation de l'ion métallique nécessaire à l'activité catalytique. L'EDTA peut également être utilisé pour tester la biodisponibilité des métaux lourds dans les sédiments. Cependant, il peut affecter la biodisponibilité des métaux en solution, ce qui peut soulever des inquiétudes quant à ses effets sur l'environnement, en particulier compte tenu de ses utilisations et applications répandues.