U heeft geen artikelen in uw winkelwagen
Natriumcarbonaat
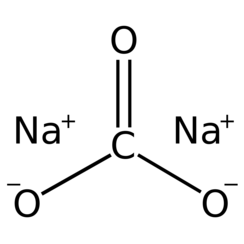
Natriumcarbonaat, Na2CO3 (ook bekend als soda, soda as en soda-kristallen) is de anorganische verbinding met de formule Na2CO3 en de verschillende hydraten ervan. Alle vormen zijn witte, in water oplosbare zouten. Alle vormen hebben een sterk alkalische smaak en geven matig alkalische oplossingen in water. Historisch gezien werd het gewonnen uit de as van planten die groeien in natriumrijke bodems. Omdat de as van deze natriumrijke planten merkbaar verschilde van de as van hout (ooit gebruikt om potas te produceren), werd natriumcarbonaat bekend als "natriumcarbonaat". Het wordt in grote hoeveelheden geproduceerd uit natriumchloride en kalksteen volgens het Solvay-proces.
Natriumcarbonaat wordt verkregen als drie hydraten en als het watervrije zout:
natriumcarbonaat-decahydraat (natron), Na2CO3 · 10H2O, dat gemakkelijk uitbloeit om het monohydraat te vormen.
natriumcarbonaat-heptahydraat (niet bekend in minerale vorm), Na2CO3 · 7H2O.
natriumcarbonaat-monohydraat (thermonatriet), Na2CO3 · H2O. Ook wel bekend als kristalcarbonaat.
watervrij natriumcarbonaat, ook wel gecalcineerde soda genoemd, wordt gevormd door de hydraten te verwarmen. Het wordt ook gevormd wanneer natriumwaterstofcarbonaat wordt verwarmd (gecalcineerd), b.v. in de laatste stap van het Solvay-proces.
Het decahydraat wordt gevormd uit wateroplossingen die kristalliseren in het temperatuurbereik -2,1 tot +32,0 C, het heptahydraat in het nauwe gebied 32,0 tot 35,4 C en boven deze temperatuur vormt het monohydraat. In droge lucht verliezen het decahydraat en het heptahydraat water om het monohydraat te geven. Andere hydraten zijn gemeld, b.v. met 2,5 eenheden water per natriumcarbonaateenheid ("pentahemihydraat").
-Belangrijkste toepassingen
Wat de grootste toepassingen betreft, wordt natriumcarbonaat gebruikt bij de vervaardiging van glas, papier, rayon, zeep en wasmiddelen.
-Glasfabricage
Natriumcarbonaat dient als een flux voor siliciumdioxide, waardoor het smeltpunt van het mengsel wordt verlaagd tot iets dat zonder speciale materialen mogelijk is. Dit "sodaglas" is licht in water oplosbaar, dus er wordt wat calciumcarbonaat aan het smeltmengsel toegevoegd om het glas onoplosbaar te maken. Fles- en vensterglas (natronkalkglas) wordt gemaakt door dergelijke mengsels van natriumcarbonaat, calciumcarbonaat en silicazand (siliciumdioxide (SiO2)) te smelten. Wanneer deze materialen worden verwarmd, geven de carbonaten kooldioxide af. Op deze manier is natriumcarbonaat een bron van natriumoxide. Soda-kalkglas is al eeuwenlang de meest voorkomende vorm van glas.
-Waterontharding
Natriumcarbonaat wordt gebruikt om water te verzachten door Mg2 + en Ca2 + te verwijderen. Deze ionen vormen bij behandeling met carbonaationen onoplosbare vaste neerslagen:
Ca2 + + CO32- → CaCO3
Natriumcarbonaat is een goedkope en in water oplosbare bron van carbonaationen.
-Additief voor levensmiddelen en koken
Natriumcarbonaat is een voedingsadditief (E500) dat wordt gebruikt als zuurteregelaar, antiklontermiddel, rijsmiddel en stabilisator. Het is een van de componenten van kansui (か ん 水), een oplossing van alkalische zouten die wordt gebruikt om ramennoedels hun karakteristieke smaak en textuur te geven. Het wordt gebruikt bij de productie van snus om de pH van het eindproduct te stabiliseren. Natriumcarbonaat wordt gebruikt bij de productie van sorbetpoeder. Het verkoelende en bruisende gevoel is het gevolg van de endotherme reactie tussen natriumcarbonaat en een zwak zuur, gewoonlijk citroenzuur, dat koolstofdioxidegas afgeeft, dat optreedt wanneer de sorbet bevochtigd wordt door speeksel. In China wordt het gebruikt om loogwater te vervangen in de korst van traditionele Kantonese maancakes en in vele andere Chinese gestoomde broodjes en noedels. Bij het koken wordt het soms gebruikt in plaats van natriumhydroxide om te logen, vooral met Duitse pretzels en loogrollen. Deze schalen worden behandeld met een oplossing van een alkalische stof om de pH van het oppervlak van het voedsel te veranderen en het bruin worden te verbeteren.
-Goedkoop, zwakke basis
Natriumcarbonaat wordt ook op verschillende gebieden als relatief sterke basis gebruikt. Als een gewone alkali heeft het de voorkeur in veel chemische processen omdat het goedkoper is dan NaOH en veel veiliger te hanteren. De zachtheid beveelt vooral het gebruik ervan in huishoudelijke toepassingen aan.
Het wordt bijvoorbeeld gebruikt als pH-regulator om stabiele alkalische omstandigheden te handhaven die nodig zijn voor de werking van de meeste fotografische filmontwikkelaars. Het is ook een veelvoorkomend additief in zwembaden en aquariumwater om de gewenste pH en carbonaathardheid (KH) te behouden. Bij het verven met vezelreactieve kleurstoffen wordt natriumcarbonaat (vaak onder een naam als natriumcarbonaat of natriumcarbonaatactivator) gebruikt om een goede chemische hechting van de kleurstof met cellulose (planten) vezels te garanderen, meestal vóór het verven (voor tie dye) , gemengd met de kleurstof (voor het verven van verf), of na het verven (voor onderdompelen). Het wordt ook gebruikt in het flotatieproces van schuim om naast CaO en andere mild basische verbindingen een gunstige pH-waarde te behouden als vlotterconditioner.
Natriumbicarbonaat (NaHCO3) of zuiveringszout, ook een onderdeel van brandblussers, wordt vaak gegenereerd uit natriumcarbonaat. Hoewel NaHCO3 zelf een tussenproduct is van het Solvay-proces, ontleedt de verwarming die nodig is om de ammoniak die het vervuilt te verwijderen, wat NaHCO3, waardoor het economischer wordt om afgewerkt Na2CO3 te reageren met CO2:
Na2CO3 + CO2 + H2O → 2NaHCO3
In een verwante reactie wordt natriumcarbonaat gebruikt om natriumbisulfiet (NaHSO3) te maken, dat wordt gebruikt voor de "sulfiet" -methode om lignine van cellulose te scheiden. Deze reactie wordt benut voor het verwijderen van zwaveldioxide uit rookgassen in energiecentrales:
Na2CO3 + SO2 + H2O → NaHCO3 + NaHSO3
Deze toepassing komt steeds vaker voor, vooral waar stations moeten voldoen aan strenge emissiecontroles.
Natriumcarbonaat wordt door de katoenindustrie gebruikt om het zwavelzuur te neutraliseren dat nodig is voor de zuurafscheiding van donzig katoenzaad.
-Diversen
Natriumcarbonaat wordt door de steenindustrie gebruikt als bevochtigingsmiddel om de hoeveelheid water te verminderen die nodig is om de klei te extruderen. Bij het gieten wordt het "bindmiddel" genoemd en wordt het gebruikt om nat alginaat te laten hechten aan gegeleerd alginaat. Natriumcarbonaat wordt gebruikt in tandpasta's, waar het werkt als een schuimmiddel en een schuurmiddel, en om de mond-pH tijdelijk te verhogen.
Natriumcarbonaat wordt ook gebruikt bij het verwerken en looien van dierenhuiden