Keine Artikel in Ihrem Warenkorb
Lysin
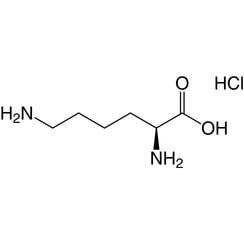
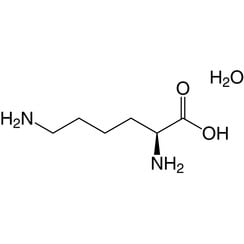
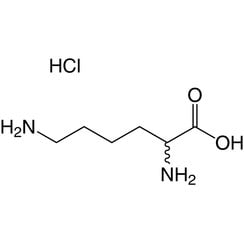
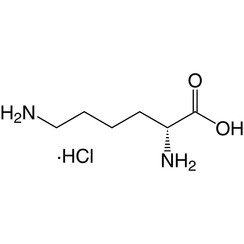
Lysin (Symbol Lys oder K) ist eine α-Aminosäure, die bei der Biosynthese von Proteinen verwendet wird. Es enthält eine α-Aminogruppe (die unter biologischen Bedingungen in der protonierten -NH3 + -Form vorliegt), eine α-Carbonsäuregruppe (die unter biologischen Bedingungen in der deprotonierten -COO- Form vorliegt) und ein Seitenkettenlysyl ((CH2) ) 4NH2), wobei es als basische, geladene (bei physiologischem pH) aliphatische Aminosäure klassifiziert wird. Es wird von den Codons AAA und AAG codiert. Wie fast alle anderen Aminosäuren ist der α-Kohlenstoff chiral und Lysin kann sich entweder auf ein Enantiomer oder eine racemische Mischung aus beiden beziehen. Für den Zweck dieses Artikels bezieht sich Lysin auf das biologisch aktive Enantiomer L-Lysin, wobei sich der α-Kohlenstoff in der S-Konfiguration befindet.
Der menschliche Körper kann kein Lysin synthetisieren. Es ist beim Menschen essentiell und muss über die Nahrung aufgenommen werden. In Organismen, die Lysin synthetisieren, gibt es zwei Hauptbiosynthesewege, den Diaminopimelat- und den α-Aminoadipatweg, die unterschiedliche Enzyme und Substrate verwenden und in verschiedenen Organismen vorkommen. Der Lysinkatabolismus erfolgt über einen von mehreren Wegen, von denen der häufigste der Saccharopinweg ist.
Lysin spielt beim Menschen verschiedene Rollen, vor allem die Proteinogenese, aber auch die Vernetzung von Kollagenpolypeptiden, die Aufnahme essentieller Mineralstoffe und die Produktion von Carnitin, das für den Fettsäurestoffwechsel von entscheidender Bedeutung ist. Lysin ist auch häufig an Histonmodifikationen beteiligt und beeinflusst somit das Epigenom. Die ε-Aminogruppe ist häufig an der Wasserstoffbindung und als allgemeine Base an der Katalyse beteiligt. Die ε-Ammoniumgruppe (NH3 +) ist an den vierten Kohlenstoff aus dem α-Kohlenstoff gebunden, der an die Carboxylgruppe (C = OOH) gebunden ist.
Aufgrund seiner Bedeutung für verschiedene biologische Prozesse kann ein Mangel an Lysin zu verschiedenen Krankheitszuständen führen, darunter defektes Bindegewebe, gestörter Fettsäurestoffwechsel, Anämie und systemischer Protein-Energie-Mangel. Im Gegensatz dazu kann ein Überfluss an Lysin, der durch einen ineffektiven Katabolismus verursacht wird, schwere neurologische Störungen verursachen.
Lysin wurde erstmals 1889 vom deutschen Biochemiker Ferdinand Heinrich Edmund Drechsel aus dem Protein Kasein in Milch isoliert. Er nannte es "Lysin". 1902 bestimmten die deutschen Chemiker Emil Fischer und Fritz Weigert die chemische Struktur von Lysin durch Synthese.