Keine Artikel in Ihrem Warenkorb
Ethanol
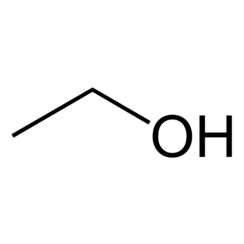
Das Ethanol (IUPAC) oder der Ethylalkohol, auch Äthanol oder Äthylalkohol, gemeinsprachlich auch (gewöhnlicher) Alkohol genannt, ist ein aliphatischer, einwertiger Alkohol mit der Summenformel C2H6O.
Die reine Substanz ist eine bei Raumtemperatur farblose, leicht entzündliche Flüssigkeit mit einem brennenden Geschmack und einem charakteristischen, würzigen (süßlichen) Geruch. Die als Lebergift eingestufte Droge wird bei der Herstellung von Genussmitteln und alkoholischen Getränken wie Wein, Bier und Spirituosen aus kohlenhydrathaltigem Material durch eine von Hefen ausgelöste Gärung in großem Maßstab produziert.
Die Vergärung von Zucker zu Ethanol ist eine der ältesten bekannten biochemischen Reaktionen. Seit dem 19. Jahrhundert wird Ethanol für industrielle Zwecke aus Ethen hergestellt. Ethanol hat eine weite Verbreitung als Lösungsmittel für Stoffe, die für medizinische oder kosmetische Zwecke eingesetzt werden, wie Duftstoffe, Aromen, Farbstoffe oder Medikamente sowie als Desinfektionsmittel. Die chemische Industrie verwendet es sowohl als Lösungsmittel als auch als Ausgangsstoff für die Synthese weiterer Produkte wie Carbonsäureethylester.
Ethanol wird energetisch als Biokraftstoff, etwa als sogenanntes Bioethanol verwendet. Beispielsweise enthält der Ethanol-Kraftstoff E85 einen Ethanolanteil von 85 Volumenprozent.
Herausragendes Merkmal des Ethanols ist seine Hydroxygruppe. Da ein Sauerstoffatom Elektronen stärker anzieht als Wasserstoff und Kohlenstoff, resultiert eine asymmetrische Verteilung der Elektronendichte entlang dieser Bindung: Es bildet sich ein molekularer Dipol. Er verleiht Ethanol seine typischen Eigenschaften. Zum einen ziehen sich die Dipole auf molekularer Ebene gegenseitig an, sodass daraus eine vergleichsweise hohe Siedetemperatur von 78 °C resultiert (Sp, Ethan = −88,6 °C), zum anderen ist Ethanol mit Flüssigkeiten mischbar, die ähnliche Dipoleigenschaften aufweisen, zum Beispiel mit Wasser und Methanol. Diese Eigenschaft wird als Hydrophilie bezeichnet. Gleichzeitig besitzt das Molekül einen organischen Rest, der ihm eine begrenzte Mischbarkeit mit rein lipophilen Substanzen verleiht. Aus diesem Grund ist Ethanol in der Chemie und Pharmazie ein wichtiges Lösungsmittel. Pflanzenauszüge oder andere Medikamente werden als alkoholische Lösungen, sogenannte „Tinkturen“, angeboten.
Ethanol bildet am Gefrierpunkt ausreichend große Einkristalle für die Bestimmung mittels Kristallstrukturanalyse. Es kristallisiert im monoklinen Kristallsystem mit der Raumgruppe Pc(Raumgruppen-Nr. 7) und weist bei 87 K die Gitterparameter a = 537,7 pm, b = 688,2 pm, c = 825,5 pm und β = 102,2° auf sowie 4 Formeleinheiten pro Elementarzelle.Die Moleküle bilden über Wasserstoffbrückenbindungen mit einem Sauerstoff-Sauerstoff-Abstand von 271,6 pm und 273,0 pm lange Ketten. Die Konformation um die Kohlenstoff-Kohlenstoff-Bindung ist in beiden Molekülen versetzt. Während die Hydroxygruppe in einem Molekül entlang der C-C-OH-Achse eine gauche-Konformation besitzt, weist das andere Molekül eine trans-Konformation auf.