Il n'y a aucun article dans votre panier
Histidine
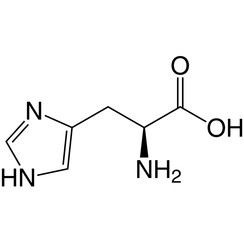
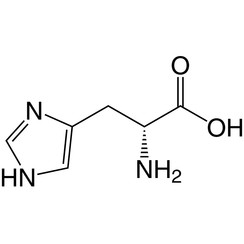
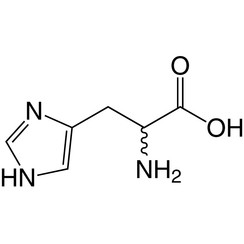
L'histidine (symbole His ou H) est un acide α-aminé utilisé dans la biosynthèse des protéines. Il contient un groupe α-amino (qui est sous forme protonée -NH3 + dans des conditions biologiques), un groupe acide carboxylique (qui est sous forme -COO déprotonée dans des conditions biologiques) et une chaîne latérale imidazole (qui est partiellement protonée) , le classe comme un acide aminé chargé positivement à pH physiologique. Initialement considéré comme essentiel uniquement pour les nourrissons, mais maintenant, des études à long terme ont montré qu'il était également essentiel pour les adultes. Il est codé par les codons CAU et CAC.
L'histidine a été isolée pour la première fois par le médecin allemand Albrecht Kossel et Sven Gustaf Hedin en 1896. C'est également un précurseur de l'histamine, un agent inflammatoire essentiel dans les réactions immunitaires. Le radical acyle est l'histidyle.
L'acide conjugué (forme protonée) de la chaîne latérale imidazole dans l'histidine a un pK d'environ 6,0. Ainsi, à un pH inférieur à 6, le cycle imidazole est généralement protoné (comme décrit par l'équation de Henderson-Hasselbalch). Le cycle imidazolium résultant porte deux liaisons NH et a une charge positive. La charge positive est également répartie entre les deux atomes d'azote et peut être représentée par deux structures de résonance également importantes. Au-dessus de pH 6, l'un des deux protons est perdu. Le proton restant du cycle imidazole peut être sur l'un ou l'autre de l'azote, donnant naissance à ce que l'on appelle les tautomères N1-H ou N3-H. Le tautomère N3-H, montré dans la figure ci-dessus, est protoné sur l'azote n ° 3 plus loin du squelette d'acide aminé portant les groupes amino et carboxyle, tandis que le tautomère N1-H est protoné sur l'azote plus proche du squelette. Le cycle imidazole / imidazolium de l'histidine est aromatique à toutes les valeurs de pH.
Les propriétés acido-basiques de la chaîne latérale de l'imidazole sont pertinentes pour le mécanisme catalytique de nombreuses enzymes. Dans les triades catalytiques, l'azote basal de l'histidine extrait un proton de la sérine, de la thréonine ou de la cystéine pour l'activer en tant que nucléophile. Dans une navette de protons histidine, l'histidine est utilisée pour déplacer rapidement les protons. Il peut le faire en extrayant un proton avec son azote basique pour en faire un intermédiaire chargé positivement, puis en utilisant une autre molécule, un tampon, pour extraire le proton de son azote acide. Dans les anhydrases carboniques, une navette histidine proton est utilisée pour éliminer rapidement les protons d'une molécule d'eau liée au zinc afin de régénérer rapidement la forme active de l'enzyme. Dans les hélices d'hémoglobine E et F, l'histidine affecte la liaison de l'oxygène et du monoxyde de carbone. Cette interaction augmente l'affinité du Fe (II) pour l'O2, mais déstabilise la liaison du CO, qui ne se lie que 200 fois plus fortement dans l'hémoglobine, contre 20 000 fois plus fortement dans l'hème libre.
La tautomérie et les propriétés acido-basiques de la chaîne latérale de l'imidazole sont caractérisées par spectroscopie RMN 15N. Les deux déplacements chimiques 14N sont comparables (environ 200 ppm, par rapport à l'acide nitrique sur l'échelle sigma, où un blindage accru correspond à un déplacement chimique accru). Les mesures spectrales RMN montrent que le déplacement chimique de N1-H diminue légèrement, tandis que le déplacement chimique de N3-H diminue de manière significative (environ 190 vs 145 ppm). Ce changement indique que le tautomère N1-H est préféré, probablement en raison de la liaison hydrogène à l'ammonium adjacent. Le blindage à N3 est considérablement réduit par l'effet paramagnétique du second ordre, qui implique une interaction permise par symétrie entre la paire isolée d'azote et les états π * excités du cycle aromatique. À pH> 9, les déplacements chimiques de N1 et N3 sont d'environ 185 et 170 ppm.