U heeft geen artikelen in uw winkelwagen
Histidine
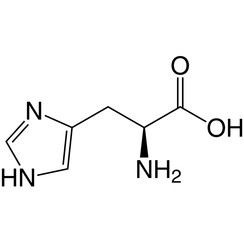
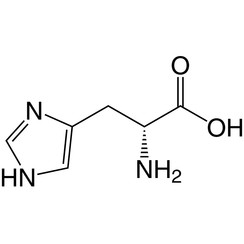
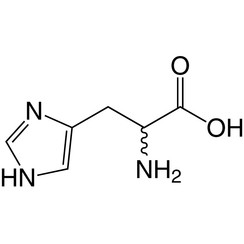
Histidine (symbool His of H) is een α-aminozuur dat wordt gebruikt bij de biosynthese van eiwitten. Het bevat een α-aminogroep (die zich in de geprotoneerde –NH3 + -vorm bevindt onder biologische omstandigheden), een carbonzuurgroep (die zich onder gedeprotoneerde –COO-vorm bevindt onder biologische omstandigheden) en een imidazool-zijketen (die gedeeltelijk geprotoneerd is ), classificeert het als een positief geladen aminozuur bij fysiologische pH. Aanvankelijk dacht het alleen essentieel te zijn voor zuigelingen, maar nu is in langetermijnstudies aangetoond dat het ook essentieel is voor volwassenen. Het is gecodeerd door de codons CAU en CAC.
Histidine werd voor het eerst geïsoleerd door de Duitse arts Albrecht Kossel en Sven Gustaf Hedin in 1896. Het is ook een voorloper van histamine, een essentieel ontstekingsmiddel bij immuunreacties. Het acylradicaal is histidyl.
Het geconjugeerde zuur (geprotoneerde vorm) van de imidazoolzijketen in histidine heeft een pKa van ongeveer 6,0. Dus bij een pH van minder dan 6 wordt de imidazoolring meestal geprotoneerd (zoals beschreven door de Henderson-Hasselbalch-vergelijking). De resulterende imidazoliumring draagt twee NH-bindingen en heeft een positieve lading. De positieve lading is gelijk verdeeld tussen beide stikstofatomen en kan worden weergegeven met twee even belangrijke resonantiestructuren. Boven pH 6 gaat een van de twee protonen verloren. Het resterende proton van de imidazoolring kan op beide stikstof zitten, wat aanleiding geeft tot wat bekend staat als de N1-H- of N3-H-tautomeren. Het N3-H-tautomeer, weergegeven in de bovenstaande figuur, wordt geprotoneerd op stikstof # 3, verder van de aminozuurruggengraat die de amino- en carboxylgroepen draagt, terwijl het N1-H-tautomeer wordt geprotoneerd op de stikstof dichter bij de ruggengraat. De imidazol / imidazoliumring van histidine is aromatisch bij alle pH-waarden.
De zuur-basiseigenschappen van de imidazol-zijketen zijn relevant voor het katalytische mechanisme van veel enzymen. In katalytische triaden onttrekt de basale stikstof van histidine een proton uit serine, threonine of cysteïne om het als nucleofiel te activeren. In een histidine-protonshuttle wordt histidine gebruikt om snel protonen te verplaatsen. Het kan dit doen door een proton te abstraheren met zijn basische stikstof om een positief geladen tussenproduct te maken en vervolgens een ander molecuul, een buffer, te gebruiken om het proton uit zijn zure stikstof te extraheren. In koolzuuranhydrasen wordt een histidine-protonshuttle gebruikt om protonen snel weg te spoelen van een zinkgebonden watermolecuul om de actieve vorm van het enzym snel te regenereren. In helices E en F van hemoglobine beïnvloedt histidine de binding van zowel zuurstof als koolmonoxide. Deze interactie verhoogt de affiniteit van Fe (II) voor O2, maar destabiliseert de binding van CO, dat slechts 200 keer sterker bindt in hemoglobine, vergeleken met 20.000 keer sterker in vrije haem.
Het tautomerisme en de zuur-basiseigenschappen van de imidazoolzijketen worden gekenmerkt door 15N NMR-spectroscopie. De twee chemische verschuivingen van 14N zijn vergelijkbaar (ongeveer 200 ppm, ten opzichte van salpeterzuur op de sigmaschaal, waarop verhoogde afscherming overeenkomt met verhoogde chemische verschuiving). NMR-spectrale metingen laten zien dat de chemische verschuiving van N1-H lichtjes daalt, terwijl de chemische verschuiving van N3-H aanzienlijk daalt (ongeveer 190 vs. 145 ppm). Deze verandering geeft aan dat het N1-H tautomeer de voorkeur heeft, mogelijk vanwege waterstofbinding aan het naburige ammonium. De afscherming bij N3 wordt aanzienlijk verminderd door het paramagnetische effect van de tweede orde, dat een symmetrie-toegestane interactie tussen het stikstof-eenzame paar en de aangeslagen π * -toestanden van de aromatische ring met zich meebrengt. Bij pH> 9 zijn de chemische verschuivingen van N1 en N3 ongeveer 185 en 170 ppm.