Non ci sono articoli nel tuo carrello
Istidina
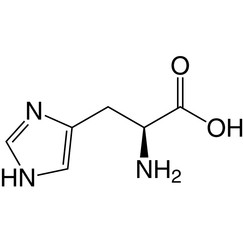
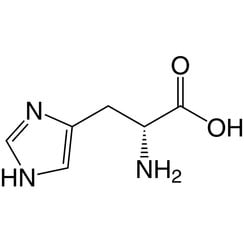
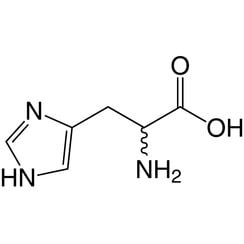
L'istidina (simbolo His o H) è un α-amminoacido utilizzato nella biosintesi delle proteine. Contiene un gruppo α-ammino (che è nella forma protonata -NH3 + in condizioni biologiche), un gruppo acido carbossilico (che è in forma deprotonata -COO in condizioni biologiche) e una catena laterale imidazolo (che è parzialmente protonata) , lo classifica come amminoacido a carica positiva a pH fisiologico. Inizialmente pensato per essere essenziale solo per i neonati, ma ora studi a lungo termine hanno dimostrato che è essenziale anche per gli adulti. È codificato dai codoni CAU e CAC.
L'istidina è stata isolata per la prima volta dal medico tedesco Albrecht Kossel e Sven Gustaf Hedin nel 1896. È anche un precursore dell'istamina, un agente infiammatorio essenziale nelle reazioni immunitarie. Il radicale acilico è istidile.
L'acido coniugato (forma protonata) della catena laterale dell'imidazolo nell'istidina ha un pKa di circa 6,0. Quindi, a pH inferiore a 6, l'anello imidazolico è solitamente protonato (come descritto dall'equazione di Henderson-Hasselbalch). L'anello di imidazolio risultante porta due legami NH e ha una carica positiva. La carica positiva è equamente distribuita tra i due atomi di azoto e può essere rappresentata da due strutture di risonanza altrettanto importanti. Al di sopra del pH 6, uno dei due protoni viene perso. Il protone rimanente dell'anello imidazolico può essere sull'azoto, dando origine a quelli che sono noti come tautomeri N1-H o N3-H. Il tautomero N3-H, mostrato nella figura sopra, è protonato sull'azoto # 3 più lontano dalla spina dorsale dell'amminoacido che porta i gruppi ammino e carbossile, mentre il tautomero N1-H è protonato sull'azoto più vicino alla spina dorsale. L'anello imidazolo / imidazolio dell'istidina è aromatico a tutti i valori di pH.
Le proprietà acido-basiche della catena laterale dell'imidazolo sono rilevanti per il meccanismo catalitico di molti enzimi. Nelle triadi catalitiche, l'azoto basale istidina estrae un protone da serina, treonina o cisteina per attivarlo come nucleofilo. In una navetta protonica istidina, l'istidina viene utilizzata per spostare rapidamente i protoni. Può farlo astrando un protone con il suo azoto basico per creare un intermedio caricato positivamente e quindi utilizzando un'altra molecola, un tampone, per estrarre il protone dal suo azoto acido. Nelle anidrasi carboniche, una navetta protonica dell'istidina viene utilizzata per eliminare rapidamente i protoni da una molecola di acqua legata allo zinco per rigenerare rapidamente la forma attiva dell'enzima. Nelle eliche di emoglobina E ed F, l'istidina influenza il legame sia dell'ossigeno che del monossido di carbonio. Questa interazione aumenta l'affinità di Fe (II) per O2, ma destabilizza il legame di CO, che si lega solo 200 volte più fortemente nell'emoglobina, rispetto a 20.000 volte più fortemente nell'eme libero.
La tautomeria e le proprietà acido-basiche della catena laterale dell'imidazolo sono caratterizzate dalla spettroscopia NMR 15 N. I due cambiamenti chimici 14N sono comparabili (circa 200 ppm, rispetto all'acido nitrico sulla scala sigma, dove una maggiore schermatura corrisponde a un aumento dello spostamento chimico). Le misurazioni spettrali NMR mostrano che lo spostamento chimico di N1-H diminuisce leggermente, mentre lo spostamento chimico di N3-H diminuisce in modo significativo (circa 190 contro 145 ppm). Questa variazione indica che il tautomero N1-H è preferito, probabilmente a causa del legame idrogeno con l'ammonio adiacente. La schermatura a N3 è significativamente ridotta dall'effetto paramagnetico del secondo ordine, che implica un'interazione consentita dalla simmetria tra la coppia solitaria dell'azoto e gli stati π * eccitati dell'anello aromatico. A pH> 9 gli shift chimici di N1 e N3 sono approssimativamente di 185 e 170 ppm.