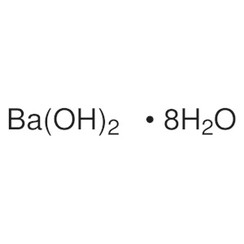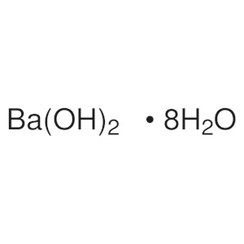Non ci sono articoli nel tuo carrello
Idrossido di bario
L'idrossido di bario è un composto chimico con la formula chimica Ba (OH) 2 (H2O) x. Il monoidrato (x = 1), noto come barite o acqua di barite, è uno dei composti più importanti del bario. Questo monoidrato granulare bianco è la solita forma commerciale.
Applicazioni
A livello industriale, l'idrossido di bario viene utilizzato come precursore di altri composti di bario. Il monoidrato viene utilizzato per disidratare e rimuovere il solfato da vari prodotti. Questa applicazione sfrutta la bassissima solubilità del solfato di bario. Questa applicazione industriale viene applicata anche alle applicazioni di laboratorio.
-Uso di laboratorio
L'idrossido di bario viene utilizzato in chimica analitica per la titolazione di acidi deboli, in particolare acidi organici. La soluzione acquosa limpida è garantita priva di carbonato, a differenza di quella di idrossido di sodio e idrossido di potassio, poiché il carbonato di bario è insolubile in acqua. Ciò consente di utilizzare indicatori come la fenolftaleina o la timolftaleina (con variazioni di colore alcaline) senza il rischio di errori di titolazione dovuti alla presenza di ioni carbonato, che sono molto meno basici.
L'idrossido di bario viene occasionalmente utilizzato nella sintesi organica come base forte, ad esempio per l'idrolisi di esteri e nitrili e come base nelle condensazioni aldoliche.
È stato utilizzato per idrolizzare uno dei due gruppi esteri equivalenti in dimetilendecandioato.
L'idrossido di bario viene anche utilizzato nella decarbossilazione degli amminoacidi che liberano il carbonato di bario.
Viene anche utilizzato nella preparazione di ciclopentanone, diacetone alcol e γ-lattone D-Gulonic.
L'idrossido di bario si decompone in ossido di bario se riscaldato a 800 ° C. La reazione con l'anidride carbonica dà carbonato di bario. La soluzione acquosa, fortemente alcalina, subisce reazioni di neutralizzazione con acidi. Pertanto, forma solfato di bario e fosfato di bario con acido solforico e acido fosforico, rispettivamente. La reazione con l'idrogeno solforato produce solfuro di bario. La precipitazione di molti sali di bario insolubili o meno solubili può derivare da una doppia reazione di sostituzione quando una soluzione acquosa di idrossido di bario viene miscelata con molte soluzioni di altri sali metallici.
Le reazioni dell'idrossido di bario con i sali di ammonio sono altamente endotermiche. La reazione dell'idrossido di bario ottaidrato con cloruro di ammonio o tiocianato di ammonio viene spesso utilizzata come dimostrazione in classe, producendo temperature sufficientemente fredde da congelare l'acqua e abbastanza acqua da sciogliere la miscela risultante.