Non ci sono articoli nel tuo carrello
1,4-Ditiotreitolo (DTT)
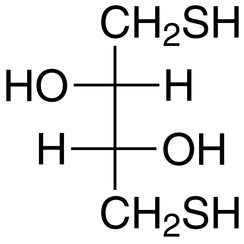
Ditiotreitolo (DTT) è il nome generico di un reagente redox a piccola molecola, noto anche come reagente di Cleland. La formula del Ditiotreitolo è C4H10O2S2 e a destra è mostrata la struttura chimica di uno dei suoi enantiomeri in forma ridotta; la forma ossidata è un anello a 6 termini legato a disolfuro. Il reagente viene spesso utilizzato nella sua forma racemica perché entrambi gli enantiomeri sono reattivi. Il nome deriva dallo zucchero dei quattro cavoli, tre. DTT ha un composto epimerico ("sorella"), il ditioeritritolo (DTE)
Il DTT viene utilizzato come agente riducente o agente "deprotettivo" per il DNA tiolato. Gli atomi terminali di zolfo del DNA tiolato tendono a formare dimeri in soluzione, soprattutto in presenza di ossigeno. La dimerizzazione riduce significativamente l'efficienza delle successive reazioni di accoppiamento come l'immobilizzazione del DNA sull'oro nei biosensori. Tipicamente, il ditiotreitolo viene miscelato con una soluzione di DNA e viene quindi rimosso mediante filtrazione (per il catalizzatore solido) o mediante cromatografia (per la forma liquida). La procedura di rimozione del DTT viene spesso definita "desalificazione". In generale, il DTT viene utilizzato come agente protettivo che previene l'ossidazione dei gruppi tiolici.
Il DTT viene spesso utilizzato per ridurre i legami disolfuro delle proteine e, più in generale, per impedire la formazione di legami disolfuro intramolecolari e intermolecolari tra i residui di cisteina delle proteine. Ma anche il DTT non può ridurre i legami disolfuro sepolti (inaccessibili ai solventi), quindi la riduzione dei legami disolfuro viene talvolta eseguita in condizioni denaturanti (ad esempio, ad alte temperature o in presenza di un forte agente di denaturazione come 6 M guanidinio cloruro, 8 M urea , o 1% di sodio dodecil solfato). Il DTT viene spesso utilizzato insieme al sodio dodecil solfato in SDS-PAGE per denaturare ulteriormente le proteine riducendo i loro legami disolfuro per consentire una migliore separazione delle proteine durante l'elettroforesi. Grazie alla sua capacità di ridurre i legami disolfuro, il DTT può essere utilizzato per denaturare il CD38 sui globuli rossi. Al contrario, l'esposizione di vari legami disolfuro al solvente può essere determinata dalla loro velocità di declino in presenza di DTT.
Il DTT può essere utilizzato anche come agente ossidante. Il vantaggio principale è che in realtà non popola specie miste disolfuro, a differenza di altri agenti come il glutatione. In casi molto rari si può formare un addotto DTT, cioè i due atomi di zolfo del DTT possono formare legami disolfuro con atomi di zolfo diversi; in tali casi il DTT non può ciclizzare perché privo di tali tioli liberi residui