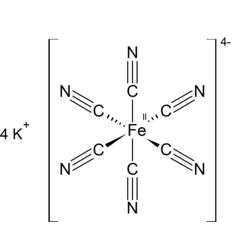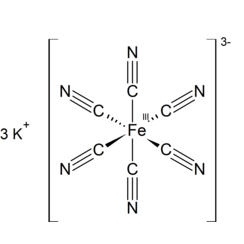Non ci sono articoli nel tuo carrello
Potassio esacianoferrato
Il ferricianuro di potassio, l'esacianoferrato di potassio o il sale di liscivia rossa è il composto chimico con la formula K3 [Fe (CN) 6]. Questo sale rosso brillante contiene lo ione [Fe (CN) 6] 3− coordinato ottaedrico. [2] È solubile in acqua e la soluzione mostra una fluorescenza giallo-verde. Fu scoperto nel 1822 da Leopold Gmelin e inizialmente fu utilizzato nella produzione di coloranti blu oltremare.
Il composto è ampiamente utilizzato nei disegni cianografici e nella fotografia (processo cianotipico). Il ferricianuro di potassio viene utilizzato in varie tonalità di stampa fotografica. Il ferricianuro di potassio è stato utilizzato come agente ossidante per rimuovere l'argento durante la lavorazione di negativi e positivi a colori, un processo chiamato sbiancamento. Poiché gli sbiancanti al ferricianuro di potassio sono dannosi per l'ambiente, di breve durata e in grado di rilasciare gas acido cianidrico se miscelati con acido, gli sbiancanti ferrici EDTA sono stati utilizzati nella lavorazione del colore sin dall'introduzione del processo Kodak C-41 nel 1972. Nella litografia a colori, il ferricianuro di potassio viene utilizzato per ridurre le dimensioni dei punti di colore senza ridurne il numero, come un tipo di correzione manuale del colore chiamata incisione a punti. Viene anche utilizzato nella fotografia in bianco e nero con tiosolfato di sodio (ipo) per ridurre la densità di una stampa negativa o di gelatina d'argento, la miscela è nota come agente riducente di Farmer's; questo può aiutare a risolvere i problemi causati dalla sovraesposizione del negativo o a schiarire le alte luci nella stampa.
Il composto è anche utilizzato per indurire ferro e acciaio, nella galvanica, nella tintura della lana, come reagente di laboratorio e come agente ossidante delicato in chimica organica.
Il ferricianuro di potassio è anche uno dei due composti presenti nella soluzione dell'indicatore ferroxile (insieme alla fenolftaleina) che diventa blu (blu di Prussia) in presenza di ioni Fe2 +, e quindi può essere utilizzato per rilevare l'ossidazione del metallo che porterà alla ruggine. È possibile calcolare il numero di moli di ioni Fe2 + utilizzando un colorimetro, a causa del colore molto intenso del blu di Prussia Fe4 [Fe (CN) 6] 3.
Il ferricianuro di potassio è spesso utilizzato in esperimenti fisiologici come mezzo per aumentare il potenziale redox di una soluzione (E ° '~ 436 mV a pH 7). Come tale, può ossidare il citocromo c ridotto (E ° '~ 247 mV a pH 7) in mitocondri isolati intatti. La ditionite di sodio è comunemente usata come agente riducente in tali esperimenti (E ~ ~ -420 mV a pH 7).
l'esacianoferrato di potassio viene utilizzato per determinare il potere riducente ferrico di un campione (estratto, composto chimico, ecc.). Tale misurazione viene utilizzata per determinare la proprietà antiossidante di un campione.
Il ferricianuro di potassio è utilizzato in molti biosensori amperometrici come agente di trasferimento di elettroni che sostituisce l'agente di trasferimento di elettroni naturale di un enzima, come l'ossigeno, come con l'enzima glucosio ossidasi. È usato come ingrediente in molti misuratori di glicemia disponibili in commercio per l'uso da parte dei diabetici.
Il ferricianuro di potassio è combinato con idrossido di potassio (o idrossido di sodio come sostituto) e acqua per formulare l'agente di Murakami. Questo mordenzante viene utilizzato dai metallografi per fornire contrasto tra le fasi legante e carburo nei carburi cementati.
-Blu Pruisic
Il blu di Prussia, il pigmento blu profondo nel progetto, è generato dalla reazione di K3 [Fe (CN) 6] con ioni ferrosi (Fe2 +) e K4 [Fe (CN) 6] con sali di ferro.
In istologia, il ferricianuro di potassio viene utilizzato per rilevare il ferro ferroso nei tessuti biologici. Il ferricianuro di potassio reagisce con il ferro ferroso in soluzione acida per produrre il pigmento blu insolubile, comunemente indicato come blu di Turnbull o blu di Prussia. Per rilevare il ferro (Fe3 +), viene utilizzato il ferrocianuro di potassio al posto del metodo di colorazione blu di Prussia di Perls. Il materiale formato nella reazione blu di Turnbull e il composto formato nella reazione blu di Prussia sono gli stessi.