U heeft geen artikelen in uw winkelwagen
Natriumacetaat
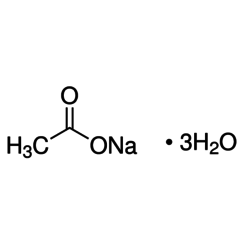
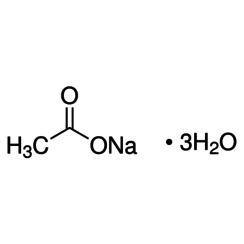
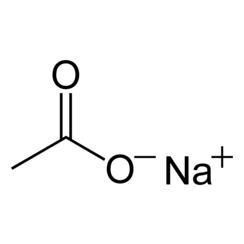
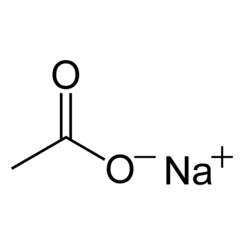
Natriumacetaat, CH3COONa, ook wel afgekort NaOAc, is het natriumzout van azijnzuur. Dit kleurloze, vervloeiende zout heeft een breed scala aan toepassingen.
Toepassingen
-Biotechnologisch
Natriumacetaat wordt gebruikt als koolstofbron voor het kweken van bacteriën. Natriumacetaat is ook nuttig voor het verhogen van opbrengsten van DNA-isolatie door ethanolprecipitatie.
-Industrieel
Natriumacetaat wordt gebruikt in de textielindustrie om afvalstromen van te neutraliseren en ook als fotoresist bij het gebruik van anilinekleurstoffen. Het is ook een beitsmiddel bij het looien van chroom en helpt vulkanisatie van chloropreen bij de productie van synthetisch rubber tegen te gaan. Bij de verwerking van katoen voor wegwerp-wattenschijfjes wordt natriumacetaat gebruikt om de opbouw van statische elektriciteit te elimineren.
-Levensduur beton
Natriumacetaat wordt gebruikt om waterschade aan beton te verminderen door als afdichtingsmiddel voor beton te fungeren, terwijl het ook milieuvriendelijker en goedkoper is dan het veelgebruikte epoxyalternatief voor het afdichten van beton tegen waterpermeatie.
-Voedsel
Natriumacetaat kan als smaakmaker aan voedsel worden toegevoegd, soms in de vorm van natriumdiacetaat, een één-op-één-complex van natriumacetaat en azijnzuur, gegeven het E-nummer E262. Het wordt vaak gebruikt om chips een zout- en azijnsmaak te geven.
-Buffer oplossing
Een oplossing van natriumacetaat en azijnzuur kan als buffer dienen om een relatief constante pH-waarde te behouden. Dit is vooral nuttig in biochemische toepassingen waar reacties pH-afhankelijk zijn in een licht zuur bereik (pH 4-6).
-Verwarmingskussen
Natriumacetaat wordt ook gebruikt in verwarmingspads, handwarmers en heet ijs. Natriumacetaat trihydraatkristallen smelten bij 136,4 ° F / 58 ° C (tot 137,12 ° F / 58,4 ° C), oplossend in hun kristalwater. Wanneer ze worden verwarmd tot voorbij het smeltpunt en vervolgens afkoelen, wordt de waterige oplossing oververzadigd. Deze oplossing kan tot kamertemperatuur afkoelen zonder kristallen te vormen. Door op een metalen schijf in het verwarmingskussen te drukken, wordt een nucleatiecentrum gevormd, waardoor de oplossing terug kristalliseert tot vast natriumacetaat trihydraat. Het bindingsvormingsproces van kristallisatie is exotherm. De latente smeltwarmte is ongeveer 264–289 kJ / kg. In tegenstelling tot sommige soorten warmtepakketten, zoals die welke afhankelijk zijn van onomkeerbare chemische reacties, kan een warmtepak van natriumacetaat gemakkelijk opnieuw worden gebruikt door het pakket een paar minuten in kokend water onder te dompelen, totdat de kristallen volledig zijn opgelost en het pakket langzaam laat koel tot kamertemperatuur.